摘要
本研究目的为探讨屈颈是颈脊髓硬膜外静脉丛充血在平山病发病机制中的可能作用。平山病患者屈颈位MRI可见硬膜囊与颈椎后弓分离并向前压迫脊髓。尸体研究发现显示脊髓前角不对称改变,与慢性缺血性损伤相一致,这可能是由于屈颈时的动脉供血不足或硬膜囊压迫引起的微循环改变。
一名15岁的上肢远端无力5年的患者,MRI证实了屈颈时硬膜囊后方静脉丛扩张,且经血管造影证实,接受C3至C6椎板切除术加硬膜成形术。术后一年随访示患者的临床状况保持稳定。在平山病中,屈颈位硬膜囊压迫脊髓可能是最重要的致病因素。但是,屈颈时后方静脉丛充血可能在脊髓缺血性改变中起一定作用。
关键词:屈颈性脊髓病;平山病;青少年上肢远端肌萎缩症;硬膜外静脉充血
平山病(Hirayama disease, HD)是一种罕见的脊髓病,在东亚国家发病率更高,青年男性更易受累[1],通常表现为隐匿起病、缓慢进展的上肢远端不对称性肌肉萎缩,通常具有一定自限性。
目前平山病的发病机制仍存在争议,尸体研究表明平山病患者颈脊髓前角存在慢性缺血性损伤[2];影像学表明,屈颈时脊髓后方拉紧的硬膜囊与椎管后壁分离,并压迫脊髓,同时脊髓也受到前方椎体的压迫,从而提出“屈曲型脊髓病(cervical flexion myelopathy, CFM)”这一假说。
尽管MRI检查可以显示以上诸多典型表现,但某些病例中,这些表现并不明显。本篇文章报道了一例青年男性平山病患者,MRI检查示硬膜后方存在扩张静脉丛,且血管造影证实了这一现象。本文希望通过这一病例证实静脉丛的扩张是平山病的发病机制之一。
病例:
一名十五岁男性因上肢进行性肌无力6个月入院,其中伸指无力更为明显,右侧症状较重。除特应性皮炎外,既往病史无特殊。无神经系统疾病家族史。
临床体格检查发现前臂背侧肌萎缩,手指半屈曲状态,上肢远端肌无力,症状右侧重于左侧。双侧伸指、手指外展及内收均无力,右侧更严重;腱反射正常。
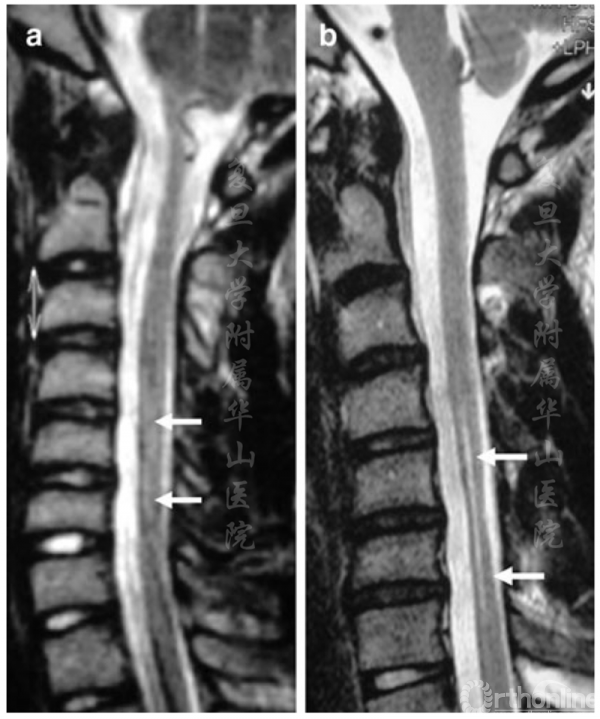
图1 MRI矢状面T2相 a.首次入院时进行的MRI检查显示C5-C6节段脊髓轻度高信号。b.四年后,出现了节段性萎缩和更明显的高信号
MRI检查显示,C5-C6节段脊髓存在轻度肌萎缩及T2加权相脊髓前角高信号,右侧更为明显(图1a)。静脉注射造影剂后可见中等程度增强。患者被诊断为平山病,随后接受了屈颈位及中立位的磁共振检查。屈颈时存在硬膜后壁的前移和硬膜后方间隙的扩大,与平山病的诊断标准一致[3-5]。建议患者使用颈托并每年随访,包括EMG和MRI评估。
从2003年到2007年,患者的临床状况一直稳定,尽管EMG显示症状略有恶化,但MRI没有变化。2007年,临床、电生理和影像学状况逐渐恶化(图1b),因此考虑手术治疗。
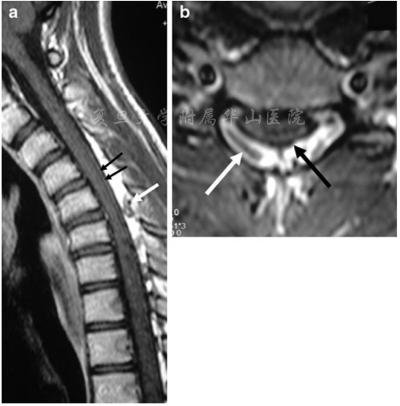
图2 屈颈位磁共振矢状和横断面T1相。(a,b)显示了造影剂给药后硬膜后壁的前移(黑色箭头)和扩大的硬膜囊后方空间。图像上可见血管流空影(白色箭头)
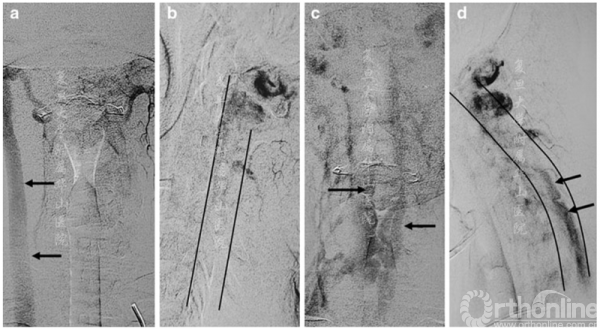
图3 左侧椎体血管造影晚期静脉相:前后位(a,c)和侧位(b,d),中立位(a,b)和屈颈位(c,d)。在中立位,右颈静脉清晰可见(a中的箭头),而当硬膜外静脉丛充血时,右颈静脉变得不透明(c和d中的箭头)。在b和d中勾勒了椎管的前后轮廓
MRI(图2a,b)和CT血管造影显示屈颈时的硬膜外静脉丛明显扩张,术前进行了脑和颈部血管造影以排除血管分流(图3a-d)。屈颈时观察到静脉血从椎管外静脉流入椎管内静脉,硬膜后方静脉丛扩张。次日患者接受成功C4-C6及颈部硬膜成形术,硬膜固定至切除的椎板边缘。患者病情平稳,症状部分恢复(强度主观提高)。在为期12个月的随访中,患者的状况保持不变。
讨论:
屈颈性脊髓病由日本学者平山惠造于1959年首次提出[6]。该病常见于青少年男性,其特征为不对称性运动功能障碍,早期被认为是脊髓侧索硬化症(amyotrophic lateral sclerosis, ALS)的特殊类型。上世纪80年代首次报道了一例尸体解剖结果,使得人们第一次认识到其病理改变为脊髓前角的缺血性损伤,不伴有血栓或其他血管异常[2]。
平山病的发病机制仍然存在争议,有学者认为该病是由于椎体及椎管内结构发育不匹配,从而导致屈颈时硬膜囊前移;有学者认为由于青少年男性生长发育速度较快[7],因此更容易受累。
和本例病例类似,一些平山病病例也合并特应性皮炎,但是否与发病机制有关目前不明确[8]。MRI检查发现,平山病患者在屈颈时脊髓前移并紧贴椎体后壁,同时可伴有硬膜囊后壁的前移。
近期,手术当中取得的一些硬膜标本的组织学研究显示了弹性纤维的不规则排列,这种组织学变化可能导致了硬膜组织拉伸能力减弱。经测量,屈颈时椎管后壁可较中立位拉伸多达5cm[9]。绷紧的硬膜无法适应拉长的骨性结构,因此只能前移,从而压迫前方脊髓至椎体后缘。
本报道及近期报道的另外两例病例分被接受了血管造影检查[10],显示屈颈时脊髓前动脉前移,紧靠椎体后缘,但血流可维持稳定;但这一发现也存在争议[2,3,10],因为有学者认为脊髓的压迫可能导致脊髓前部动脉微循环障碍,这与前角的慢性缺血性损伤相符[2]。
MRI常可见硬膜后方静脉丛扩张,其病理生理机制至今仍有争议,主要有以下三种假说:
(1)硬膜前移引起的硬膜外间隙负压;
(2)屈颈时颈静脉内的静脉引流受损,从而导致血流转向硬膜外静脉丛;
(3)前静脉丛血流被挤压流向后方静脉丛。
据我们所知,仅在1例HD病例中进行了硬膜外静脉压力的测量[11],结果表明中立位和屈颈位硬膜外静脉压力无明显差异,因此表明硬膜外丛的“被动”扩张与平山病的发病机制无关。此现象有必要进一步探究。
在本例中,屈颈时颈静脉被阻塞并且硬膜外改道成为惟一可能的引流时,Valsalva动作可能可以导致脊髓微循环中的静脉停滞,从而加重脊髓缺血。硬脊膜动静脉瘘导致脊髓病的病因由于静脉压升高引起静脉引流障碍从而导致的慢性缺血[12]。在这种情况下,静脉回流因素是主要致病因素。
根据“静脉假说”,由于静脉充血导致的脊髓微循环障碍可能与平山病发病机制中的动脉缺血同时存在。然而,到目前为止,平山病发病机理中最重要的因素仍然是无弹性硬脑膜对脊髓的直接损伤[11]。
尽管对于CFM的外科治疗仍然存在争议,但尽管采取保守治疗但病情恶化的患者,旨在缓解脊髓压迫的颈椎固定或硬膜成形术似乎是有益的[13-15]。
结论:
屈颈时直接硬膜造影显示后硬膜外丛的静脉充血进一步证实了MRI表现,并提示静脉丛扩张对CFM的发病机制可能有贡献。
参考文献:
1. Polo A, Dossi MC, Fiaschi A et al (2003) Peripheral and segmental spinal abnormalities of median and ulnar somatosensory evoked potentials in Hirayama’s disease. J Neurol Neurosurg Psychiatry 74:627–632
2. Hirayama K (2000) Juvenile muscular atrophy of distal upper extremity (Hirayama disease): focal cervical ischemic poliomyelopathy. Neuropathology 20:S91–S94
3. Chi-jen C, Hui-Ling H, Ying-Chi T et al (2004) Hirayama flexion mielopathy: neutral position MR imaging findings—importance of loss of attachment. Radiology 231:39–44
4. Hemant AS, Rakesh SS, Firosh KK et al (2008) Imaging features in Hirayama disease. Neurol India 56:22–26
5. Kikuchi S, Shinpo K, Nino M et al (2002) Cervical myelopathy due to a ‘‘tight dural canal in flexion’’ with a posterior epidural cavity. Intern Med 41:746–748
6. Hirayama K, Toyokura Y, Tsubak T (1959) Juvenile muscular atrophy of unilateral extremity: a new clinical entity. Psychiatria et Neurologia Japonica 61:2190–2197
7. Toma S, Shiozawa Z (1995) Amyotrophic cervical myelopathy in adolescence. J Neurol Neurosurg Psychiatry 58:56–64
8. Kira J, Ochi H (2001) Juvenile muscular atrophy of the distal upper limb (Hirayama disease) associated with atopy. J Neurol Neurosurg Psychiatry 70:798–801
9. Chen CJ, Chen CM, Wu CL et al (1998) Hirayma disease: MR diagnosis. AJNR Am J Neuroradiol 19:365–368
10. Elsheickh B, Kissel JT, Christoforidis G et al (2009) Spinal angiography and epidural venography in juvenile muscular atrophy of the distal arm ‘‘Hirayama disease’’. Muscle Nerve 40:206–212
11. Patel TR, Chiocca EA, Freimer ML, Christoforidis GA (2009) Lack of epidural pressure change with neck flexion in a patient with Hirayama disease: case report. Neurosurgery 64:E1196–E1197
12. Criscuolo GR, Oldfield EH, Doppman JL (1989) Reversible acute and subacute myelopathy in patients with dural arteriovenous fistulas. Foix-Alajouanine syndrome reconsidered. J Neurosurg 70:354–359
13. Fujimoto Y, Oka S, Tanaka S, Nishikawa K et al (2002) Pathophysiology and treatment for cervical flexion myelopathy. Eur Spine J 11:276–285
14. Konno S, Goto S, Muratami M et al (1997) Juvenile muscular atrophy of distal upper extremity: pathologic findings of the dura mater and surgical management. Spine 22:486–492
15. Chiba S, Yonekura K, Nonaka M et al (2004) Advanced Hirayama disease with successful improvement of activities of daily living by operative reconstruction. Intern Med 43:79–81
相关阅读:
华山骨科“平山病”系列研究之——颠覆传统观念的“严重”神经系统疾病
不会“自限”的平山病(一)——平山病病情进展的影像学定量评估