郑超君a 朱愈b 朱冬青a 吕飞舟a 夏新雷a 姜建元a 马晓生a
a.复旦大学附属华山医院
b.美国上州大学医学院
关键信息:
1.在运动单位数目估计(MUNE)检查中,和正常对照组相比,平山病功能性运动单位的数量显著降低;
2.平山病患者无症状侧的MUNE值存在反常的降低;
3.病程超过4年的患者的运动单元仍会随着疾病发展进一步减少。
摘要
目的: 研究运动单位数目估计(Motor unit number estimation, MUNE)检查在定量评估平山病(Hirayama Disease, HD)运动单位丢失的严重程度及进展情况中的作用。
方法: 对46名平山病患者和32名健康对照进行了双侧小指展肌和拇短展肌的多点递增法MUNE检查,同时进行了双侧握力检查。17名平山病患者在初次检查后约1年再次接受MUNE检查。
结果: 平山病患者所有测试肌肉的MUNE值均显著降低(P<0.05=。尽管MUNE值异常低,但54.3%(25/46)的平山病患者同侧握力正常。MUNE值与病程之间有显著的负相关(P<0.05)。纵向随访MUNE结果表明,一年内平山病患者的运动单位丢失情况存在缓慢进展(P<0.05),即使病程大于4年的患者也是如此。
结论: 与对照组相比,平山病患者的功能性运动单位数量减少,即使在早期无症状阶段也是如此。此外,随着疾病的进展,平山病患者的运动单位丢失会逐渐加重。
1 介绍
平山病(Hirayama disease, HD)是一种良性神经系统疾病,主要引起年轻男性患者单侧或双侧不对称性手内在肌萎缩,主要累及C7-T1支配肌,但不引起感觉障碍[1]。平山病的病因尚不清楚。目前的一个假说是颈椎屈曲引起的慢性颈脊髓损伤(缺血和/或压迫)[2-4]。
研究表明,颈托治疗和手术干预可能是针对平山病的有效治疗方法,因为长期颈托支持或融合手术都可以避免平山病患者的颈椎屈曲[5-7]。然而,由于难以确定平山病的进展减缓是由于治疗还是疾病本身的自限性,这两种治疗方法目前仍存在争议。
常规的电生理检查(包括神经传导检查、重复神经刺激和针肌电图检查)一直是平山病诊断的重要组成部分[4,7-9]。然而,这些电生理技术不能判断平山病的严重程度和临床进展程度。因此,需要一种定量的评估方法来评估患者的平山病严重程度、进展和治疗效果。
运动单位数目估计(Motor unit number estimation, MUNE)是一种定量评估肌肉或肌群运动单位数量的方法[10,11]。MUNE值的计算公式如下:最大复合肌肉动作电位(Compound muscle potential, CMAP)/平均单个运动单位电位(Single motor unit potential, SMUP)[10]。
因此MUNE不会受到神经侧支再支配或失用性肌萎缩的影响。最新研究也证明了MUNE在评估ALS的严重性和临床进展中的价值[12-14]。但目前关于MUNE在平山病中的定量评估的研究仍然有限。
本研究旨在估测平山病患者上肢远端功能性运动单位的数量。我们还评估了MUNE检查在定量平山病严重程度和临床进展方面的作用。
2 方法
2.1 研究对象
本研究纳入了2013年5月至2016年8月于华山医院就诊的46例平山病患者和32例健康受试者。研究方案经复旦大学附属华山医院伦理委员会批准。所有参与者均签署知情同意书。健康对照和平山病患者的纳入和排除标准见既往文献[3,4]。
2.2测试方法
2.2.1 运动单位数目估计(MUNE)
研究采用了Shefner等人描述的多点递增刺激方法(图1)[13]。受试者取仰卧位,在超强刺激下用肌腹-肌腱法于双侧小指展肌(ADM)和拇短展肌(APB)记录最大CMAPs(刺激持续时间:0.2毫秒;电阻<5kΩ;Gain:1-5毫伏;Filters:10Hz-10kHz;频率:1Hz)。
每块肌肉记录三个刺激位点上的SMUPs(刺激持续时间:0.05毫秒;Gain:50-200微伏)。在每个刺激点,刺激强度逐渐增加,增量约0.1-0.5毫安,直至SMUP被诱发(全或无),三个SMUP叠加值被用以计算运动单位数目。由此每块被检肌肉可测得九个不同的SMUP。

图1.一名18岁的平山病男性患者。在症状较轻的一侧小指展肌的MUNE值减少,同时CMAP波幅降低,SMUP平均波幅增加。左图(A)显示了腕关节(1-3)、腕近端4厘米(4-6)和肘部(7-9)的三个增量,右图(B)显示了最大CMAP。SMUP:单个运动单位电位;CMAP:复合肌肉动作电位;MUNE:运动单位数目估计
采用负峰波幅进行MUNE值计算。可接受的记录的最小波幅是25μV。运动单位的数量是通过最大CMAP波幅除以9个不同的SMUP波幅的平均SMUP波幅来估计的。记录以下测量值:(1)最大CMAP的负峰波幅;(2)运动单位的数量;(3)SMUP的平均负峰波幅。
为了保证测试内部一致性和可重复性,一天内由同一电生理医师重复两次检查,间隔时间为30-60分钟。第二次测量时更换电极。
有17名平山病患者不接受长期佩戴颈托或手术治疗,并愿意接受后续随访,在初次检查后约1年重复相同的测试。
采用日本Kohden MEB-9400 EMG装置(日本东京)在皮肤温度高于32℃的情况下进行所有电生理检查。为排除测量者之间差异性的影响,所有测试均由同一位经验丰富的电生理医师进行。在初次检查时,检查者对受试者对是否患有平山病是双盲的。
2.2.2. 握力检查
使用Jamar液压握力测力计(Sammons Preston Rolyan,美国伊利诺伊州)对所有受试者的握力(HGS)进行进一步检查。所有受试者按照之前描述的测试方案进行双侧HGS测试[15,16]。握力测量取三次最大尝试的平均值,间隔时间为1分钟,结果以公斤力记录。
平山病患者平均SMUP波幅比健康受试者的平均值高两个标准差(SDs),或CMAP波幅、运动单位数目和握力比健康受试者的平均值低两个SDs即定义为异常。
2.3 统计方法
采用SPSS 12.0(IBM, Armonk, NY)分析数据。使用Kolmogorov-Smirnov检验来检验分布的正态性。根据数据的分布类型,通过独立的t检验或Mann-Whitney检验,将平山病患者在初次检查时的所有测量结果与对照组中测得的参数进行比较。并用同样的方法比较纳入随访研究的平山病患者和其他平山病患者的年龄、身高和病程。
此外,根据数据是否为正态分布,用配对t检验或Wilcoxon符号秩检验比较同侧手ADM和APB之间的测量结果。用相同的方法比较平山病患者初次和随访时时握力和MUNE的测量结果。通过卡方检验(Pearson's chi-square或连续性校正)比较平山病患者的MUNE降低比例、CMAP波幅降低比例、同侧ADM和APB之间的SMUP波幅增加的比例。
根据数据分布类型,采用组间相关系数(ICC)方法和Pearson's或Spearman's相关系数分析(CCA)方法测定病例组和对照组MUNE结果的再测信度。同时采用Pearson's或Spearman's CCA分析各MUNE测量值与病程和握力之间的相关性。P值<0.05视为有统计学意义。
3 结果
32名健康对照和46名平山病患者在初次检查时MUNE和握力的测量结果见表1。对照组与病例组在年龄和身高上均无差异(P>0.05)。

表1:平山病患者和对照组MUNE和握力的测量结果
其中a是记录了异常测量的测试数,b是可以记录CMAP或握力的测试数
与对照组相比,平山病患者双侧ADM和APB的MUNE值均显著下降(P<0.05=,而平山病患者所有测试肌肉的SMUP波幅均高于对照组(P<0.05=。平山病患者在症状侧双侧ADM和APB的最大CMAP波幅也低于对照组(P<0.05=。平山病患者双侧握力明显低于对照组(P<0.05=。与APB相比,两侧ADM的CMAP和MUNE值均有较严重的降低(P<0.05),且两侧CMAP、症状较轻侧SMUP和症状侧MUNE的异常测量次数较多(P<0.05=(表1)。
关于MUNE测量的内部可靠性,在病例组和对照组的所有被测肌肉中,初次检查时发现两次测量之间存在显著的正相关关系(P<0.05=。ICC分析进一步证实了MUNE在病例组和对照组中的重复性(P<0.05)(表1)。
此外,在平山病患者中,握力减少与同侧APB运动单位数量减少之间存在较强的正相关关系(症状侧:APB,r=0.65,P<0.05;症状较轻侧:APB,r=0.58,P<0.05)(图2)。在本研究中,MUNE值与病程也呈负相关(症状侧ADM:r=-0.50,P<0.05;APB,r=-0.48,P<0.05;症状较轻侧:ADM,r=-0.32,P<0.05;APB,r=-0.38,P<0.05)(图3)。

图2.平山病患者两侧APB MUNE值与同侧手握力的相关性。发现病例组两侧MUNE值与同侧手握力有显著的正相关关系
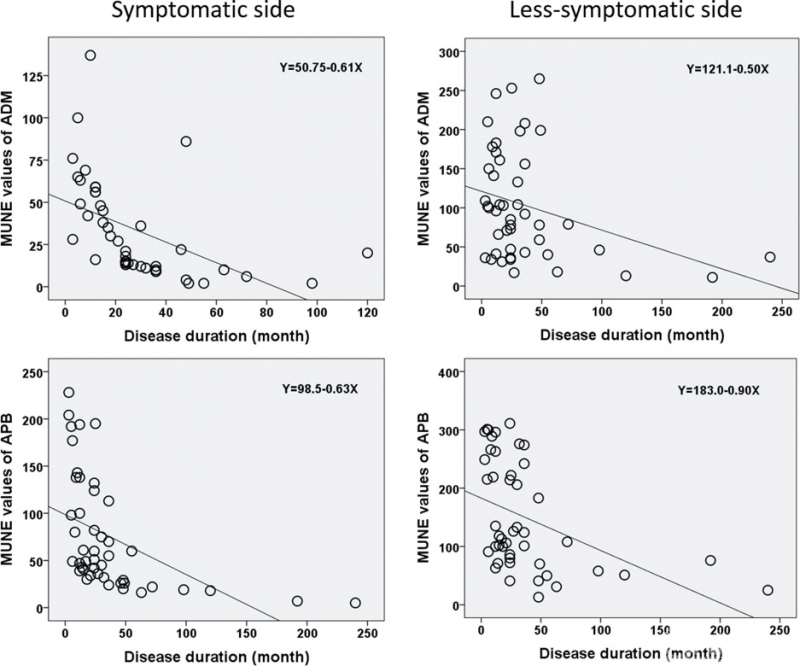
图3.平山病患者所有测试肌肉的MUNE值与病程的相关性。病例组所有测试肌肉的MUNE值与病程之间呈负相关
在17例平山病患者的随访组中,双侧APB和症状较轻侧ADM的MUNE值在初次检查后402.5±55.3(300-520)天显著下降(图4),同时双侧APB的SMUP增加(P<0.05)(表2)。相比之下,握力和CMAP在两次检查之间均未出现明显变化(P>0.05)(表2)。这17名患者与其他未参与随访研究的受试者在年龄、身高、病程等方面均无差异(P>0.05)。
此外,在6名初诊时病程超过4年的患者中,1年随访时也发现症状侧APB中MUNE值异常降低(P<0.05)。在随访中,这6例患者中的1例症状侧ADM中的CMAP完全消失。

图4.单独病例(灰线)显示MUNE在初次检查和1年随访检查之间的变化,黑色粗线代表平均值和标准差。*平山病患者的MUNE平均值在随访检查中显著下降(P<0.05)
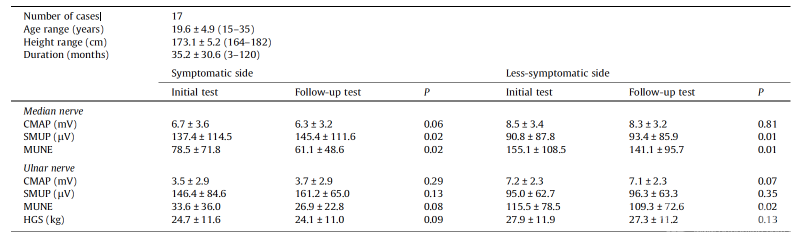
表2.平山病患者1年后MUNE和握力的随访结果
4 讨论
本研究结果显示,平山病患者的MUNE值普遍下降,且该值与运动功能之间有很强的相关性。同样重要的是,我们证明了MUNE在1年内的显著下降。这些研究结果都表明MUNE是定量评估平山病患者下运动神经元丢失和临床进展程度的可行方法。
本研究采用多点递增法进行MUNE检查,是因为它相对容易进行,且患者耐受性好[13]。通常情况下,测试一个受试者的四块肌肉只需不到30分钟。本次研究也探究了该技术的可靠性。在统计结果的基础上,我们证明了该MUNE技术在对照组中具有良好的可重复性,这与之前的报告相似[13,17]。
与之前的这些研究相比,我们在相同的健康受试者中检查了更多的肌肉。此外,在本研究中,我们使用了两种不同的统计方法(CCA和ICC)来检查多点递增MUNE技术在每个对照组受试者的四块肌肉中的复测信度。结果显示该技术能可靠地反映被测肌肉的存活运动单位数量。
在初次检查中,平山病患者的ADM较APB表现出更多的测量异常值或更严重的MUNE值降低,尽管ADM和APB都是由C8/T1段支配。这一发现表明,在平山病中ADM比APB更易受影响,这也得到了以往研究结果的支持[18,19]。然而,平山病患者中手部肌肉受累的这种模式的机制仍不清楚。一种可能的解释是供应APB和ADM的神经纤维在C8-T1段(前角/静脉神经根)的排列较为离散。
平山病患者的部分压迫性或缺血性病变中,供应ADM的神经纤维首先受损。根据Stewart等人的研究,如果神经纤维在C8-T1脊柱节段广泛交融,那么损伤可能会导致C8-T1节段供应的所有肌肉受累程度大致相同[20]。相比之下,本研究的结果意味着神经纤维可能在脊柱节段之间仍然保持相对独立的通路。
尽管MUNE明显下降,但超过33%的平山病患者在本研究测试的相同肌肉中CMAP波幅正常,表明CMAP波幅可能无法检测到平山病的早期运动单位损失。在运动神经元疾病的慢性期(如脊髓和球部肌肉萎缩和脊柱肌肉萎缩)报道中也有类似的结果,长期的神经变性引起的侧枝代偿可能是主要原因[21,22]。
本研究中平山病患者SMUP波幅的显著增加,进一步证实了平山病中存活的运动单位轴突通过侧枝代偿进行神经在支配的存在,这意味着CMAP波幅在发生严重的轴突损害之前不会发生明显改变。
根据以往的研究,再神经支配过程也可以提供一种功能补偿机制,在早期阶段维持肌力[11,23]。因此,MUNE的变化可能发生在临床发病之前。根据本研究中的回归曲线(图3),平山病发病时症状侧的MUNE预测值已明显低于正常对照组,这也提示平山病患者在临床症状出现之前,运动神经元的丢失可能已经潜在地发生了。
此外,本研究中同侧握力正常的平山病患者MUNE的显著下降也证实了这一观点。最近发表的一篇论文表明,肌肉强度通过侧方神经再支配维持在正常水平,直到侧支神经再支配速度跟不上失神经支配的速度才会有肌力下降,而去神经支配的程度要达到50%或更多的运动单位丧失才会体现出肌力下降[24]。
因此,与目前的临床生物标志物(如CMAP波幅和肌力)相比,MUNE是一种更客观、更敏感、更可靠的评估平山病的方法。此外,由于MUNE检测不依赖于疾病进展过程中的代偿过程,因此在无症状的平山病患者中甚至可以观察到MUNE的异常下降。对平山病患者亚临床期运动神经元丢失的检查,有助于鉴别平山病对运动轴突的影响,可指导进一步的治疗方式。
在本研究中,MUNE值从肌力下降开始就与疾病持续时间呈明显的负相关,这意味着平山病的运动单位丢失是随着疾病的进展而发生的。在1年的随访研究中,部分受检肌肉的MUNE显著下降,为MUNE减少与疾病进展相关的假说提供了进一步的支持,因此认为MUNE可用于监测平山病的临床进展。
1年随访中,症状侧ADM的MUNE值没有变化,可能是由于初始评估前运动单位已严重丢失所致。事实上,有一位患者通过CMAP降低发现患侧ADM的功能丧失加重。
更重要的是,在随访研究中还发现病程超过4年(4-10年)的患者MUNE显著降低。虽然早期的研究认为平山病在发病2-4年后会逐渐好转,成为自限性疾病[25],但一项大型病例研究报告证实,7.5%的平山病患者在>5年后仍有疾病进展[26]。也有越来越多的随访临床病例报告涉及病程10年甚至30年后的疾病进展[27,28]。Cerami等和Boelmans等人均认为,静止期的平山病患者在经过数月或数年的平台期后,仍可出现快速的疾病进展,最终出现严重的上肢萎缩[29,30]。
本研究结果表明,运动神经元的慢性持续变性直至轴突再生是无法补偿这种损失的,可能是部分平山病患者第二次临床进展的原因。此外,在之前的影像学研究中,我们证明了与平山病患者影像学异常不能随着疾病的进展而改善,这意味着平山病可能不是自限性的,或者需要比预期更长的时间才能停止进展[31]。
在本研究中,我们首次直接证明了病程较长的平山病患者手部远端肌肉的运动单位仍存在持续下降的现象,这说明目前常用的平山病治疗方法,如长期佩戴颈托治疗,可能并没有达到预期的良好效果,因为这种治疗方法是建立在以往疾病进展的“自限性”假说基础上的。
在回顾这些结果时,关键是要考虑一个潜在的局限性,因为方法和检查者都很容易影响MUNE的测量结果。为了解决这个问题,本研究中同时使用了固定的MUNE方法和检查人员。本研究的另一个潜在局限性是随访研究的病例数较少。如果增加病例数,可能会取得更显著的结果。然而,由于平山病是一种罕见的、隐匿的、慢性进展性疾病,因此很难收集平山病患者的随访数据。
总之,MUNE可以为定量评价平山病的运动神经元变性严重程度和临床进展提供一种简单、无创、有效、可靠的辅助检测方法,即使在疾病的早期无症状阶段也是如此。
参考文献:
[1] HIRAYAMA K. [Juvenile muscular atrophy of unilateral upper extremity (Hirayama disease)--half-century progress and establishment since its discovery] [J]. Brain Nerve, 2008, 60(1): 17-29.
[2] HIRAYAMA K. Juvenile muscular atrophy of distal upper extremity (Hirayama disease): focal cervical ischemic poliomyelopathy [J]. Neuropathology, 2000, 20 Suppl(S91-4.
[3] ZHENG C, ZHU Y, YANG S, et al. A study of dynamic F-waves in juvenile spinal muscular atrophy of the distal upper extremity (Hirayama disease) [J]. J Neurol Sci, 2016, 367(298-304.
[4] ZHENG C, ZHU D, LU F, et al. Compound Muscle Action Potential Decrement to Repetitive Nerve Stimulation Between Hirayama Disease and Amyotrophic Lateral Sclerosis [J]. J Clin Neurophysiol, 2017, 34(2): 119-25.
[5] VERMA R, LALLA R, PATIL T B, et al. Hirayama disease: a frequently undiagnosed condition with simple inexpensive treatment [J]. BMJ Case Rep, 2012, 2012(
[6] LU F, WANG H, JIANG J, et al. Efficacy of anterior cervical decompression and fusion procedures for monomelic amyotrophy treatment: a prospective randomized controlled trial: clinical article [J]. J Neurosurg Spine, 2013, 19(4): 412-9.
[7] YANG G, YANG X, ZHANG M, et al. Hirayama disease in children from mainland of China [J]. J Child Neurol, 2014, 29(4): 509-13.
[8] ZHOU B, CHEN L, FAN D, et al. Clinical features of Hirayama disease in mainland China [J]. Amyotroph Lateral Scler, 2010, 11(1-2): 133-9.
[9] WANG X N, CUI L Y, LIU M S, et al. A clinical neurophysiology study of Hirayama disease [J]. Chin Med J (Engl), 2012, 125(6): 1115-20.
[10] BROMBERG M B. Updating motor unit number estimation (MUNE) [J]. Clin Neurophysiol, 2007, 118(1): 1-8.
[11] MCCOMAS A J, FAWCETT P R, CAMPBELL M J, et al. Electrophysiological estimation of the number of motor units within a human muscle [J]. J Neurol Neurosurg Psychiatry, 1971, 34(2): 121-31.
[12] AHN S W, KIM S H, OH D H, et al. Motor unit number estimation in evaluating disease progression in patients with amyotrophic lateral sclerosis [J]. J Korean Med Sci, 2010, 25(9): 1359-63.
[13] SHEFNER J M, WATSON M L, SIMIONESCU L, et al. Multipoint incremental motor unit number estimation as an outcome measure in ALS [J]. Neurology, 2011, 77(3): 235-41.
[14] FATHI D, MOHAMMADI B, DENGLER R, et al. Lower motor neuron involvement in ALS assessed by motor unit number index (MUNIX): Long-term changes and reproducibility [J]. Clin Neurophysiol, 2016, 127(4): 1984-8.
[15] KOZICKA I, KOSTKA T. Handgrip strength, quadriceps muscle power, and optimal shortening velocity roles in maintaining functional abilities in older adults living in a long-term care home: a 1-year follow-up study [J]. Clin Interv Aging, 2016, 11(739-47.
[16] TERAOKA T. Studies on the peculiarity of grip strength in relation to body positions and aging [J]. Kobe J Med Sci, 1979, 25(1): 1-17.
[17] GAWEL M, KOSTERA-PRUSZCZYK A. Effect of age and gender on the number of motor units in healthy subjects estimated by the multipoint incremental MUNE method [J]. J Clin Neurophysiol, 2014, 31(3): 272-8.
[18] LYU R K, HUANG Y C, WU Y R, et al. Electrophysiological features of Hirayama disease [J]. Muscle Nerve, 2011, 44(2): 185-90.
[19] JIN X, JIANG J Y, LU F Z, et al. Electrophysiological differences between Hirayama disease, amyotrophic lateral sclerosis and cervical spondylotic amyotrophy [J]. BMC Musculoskelet Disord, 2014, 15(349.
[20] STEWART J D. Peripheral nerve fascicles: anatomy and clinical relevance [J]. Muscle Nerve, 2003, 28(5): 525-41.
[21] SUZUKI K, KATSUNO M, BANNO H, et al. The profile of motor unit number estimation (MUNE) in spinal and bulbar muscular atrophy [J]. J Neurol Neurosurg Psychiatry, 2010, 81(5): 567-71.
[22] GALEA V, FEHLINGS D, KIRSCH S, et al. Depletion and sizes of motor units in spinal muscular atrophy [J]. Muscle Nerve, 2001, 24(9): 1168-72.
[23] GAWEL M, ZALEWSKA E, LIPOWSKA M, et al. Motor unit number estimation as a complementary test to routine electromyography in the diagnosis of amyotrophic lateral sclerosis [J]. J Electromyogr Kinesiol, 2016, 26(60-5.
[24] BROMBERG M B, BROWNELL A A. Motor unit number estimation in the assessment of performance and function in motor neuron disease [J]. Phys Med Rehabil Clin N Am, 2008, 19(3): 509-32, ix.
[25] NASCIMENTO O J, FREITAS M R. Non-progressive juvenile spinal muscular atrophy of the distal upper limb (Hirayama's disease): a clinical variant of the benign monomelic amyotrophy [J]. Arq Neuropsiquiatr, 2000, 58(3B): 814-9.
[26] HUANG Y C, RO L S, CHANG H S, et al. A clinical study of Hirayama disease in Taiwan [J]. Muscle Nerve, 2008, 37(5): 576-82.
[27] CICERI E F, CHIAPPARINI L, ERBETTA A, et al. Angiographically proven cervical venous engorgement: a possible concurrent cause in the pathophysiology of Hirayama's myelopathy [J]. Neurol Sci, 2010, 31(6): 845-8.
[28] LI Y, REMMEL K. A case of monomelic amyotrophy of the upper limb: MRI findings and the implication on its pathogenesis [J]. J Clin Neuromuscul Dis, 2012, 13(4): 234-9.
[29] CERAMI C, VALENTINO F, PICCOLI F, et al. A cervical myelopathy with a Hirayama disease-like phenotype [J]. Neurol Sci, 2008, 29(6): 451-4.
[30] BOELMANS K, KAUFMANN J, SCHMELZER S, et al. Hirayama disease is a pure spinal motor neuron disorder--a combined DTI and transcranial magnetic stimulation study [J]. J Neurol, 2013, 260(2): 540-8.
[31] SHAO M, YIN J, LU F, et al. The Quantitative Assessment of Imaging Features for the Study of Hirayama Disease Progression [J]. Biomed Res Int, 2015, 2015(803148.
相关阅读: