复旦大学附属华山医院 邵明昊 殷骏 吕飞舟 郑超君 王洪立 姜建元
目的 评估平山病患者不同节段的颈脊髓前移以明确平山病是否存在自限性。
方法 本研究共纳入11例健康受试者以及64例平山病。根据病程不同,将患者分为5个亚组(G1组:≤1年,G2组:1-2年,G3组:2-3年,G4组:3-4年,以及G5组:≥4年)。所有研究对象均行颈椎中立位与颈椎屈曲位核磁共振成像(Magnetic resonance imaging,MRI)检测,并在C4-T1的不同节段测量脊髓后缘和颈椎管的距离(X),颈椎管前壁和后壁的距离(Y)以及颈脊髓横断面的前后径(A)和横径(B)。
结果 在屈颈位MRI中,G2-G5组的C4-5节段的X/Y值明显增加,G1-G5组的C5-6,C6-7节段的X/Y值显著增加,G5组的C7-T1节段的X/Y值显著增加(P<0.05)。增加的X/Y程度以及屈颈位X/Y的值在5组间存在显著差异(P<0.05),这可能归因于平山病病程进展过程中X/Y值快速增加。
结论 本次研究中,X/Y的变化过程表明平山病可能不存在自限性。
平山病(Hirayama disease,HD)于1959年由日本学者Hirayama首先报道[1]。目前,HD的致病机制仍然不明。Hirayama等通过尸检确认HD的病变主要发生在脊髓中央区白质、灰质,脊髓前角,以及腹侧神经根等区域[2,3]。
结合颈椎屈曲位磁共振成像(Magnetic resonance imaging,MRI)下颈髓向前移位、硬脊膜囊后方的新月形异常信号(“膜壁分离”)[3,4],以及患者常起病于生长发育高峰期1-3年后等特征,Hirayama等提出某些结构如脊柱、脊髓、神经根及硬膜在生长发育高峰期的发育不匹配可能导致了颈椎屈曲时硬膜囊后壁过度前移从而导致颈髓受压。
此外,相应节段的颈髓血供被迫注入硬膜囊后方真空的“新月型”空间内,导致颈髓前角细胞的缺血,以上可能提示着平山病的发病机制[3]。随着生长发育高峰趋于尾声,以上解剖结构之间的生长关系逐渐趋于平衡。因此,HD患者的病情逐渐改善,并可能在发病2-4年后“自限”[3,5]。
但随着HD病例数的不断增加以及相关研究的深入,学者们越来越开始质疑HD的“自限性”。大型病例报告已确认7.5%的HD患者在病程超过5年后仍然有进展情况[5],部分病例报道指出有些病程10年甚至30年以上的平山病患者仍然存在病情不断恶化的表现[6,7]。有报道证实平山病可能在“自限”数月或数年之后再次出现快速进展,并最终导致严重的肌萎缩[8,9]。
2006年,在涉及日本全国范围的大型临床病例调研中,Tashiro等证实,在部分病程超过4年以上的患者中存在“膜壁分离”现象的患者比例相对下降,从而间接证实平山病的主要致病因素可能会逐渐缓解、消失,该篇文章即是证实平山病具有自限性的关键[10]。可惜的是,至今为止尚无直接研究证据明确上述典型的“膜壁分离”特征是否与平山病的进展紧密相关并会随着病程趋于正常。
因此,在本研究中,我们试图通过测量、比较不同病程的平山病患者,动态颈MRI下,不同颈椎节段“膜壁分离”与脊髓形变程度,明确上述平山病特征性影像学特征是否会因病程的进展而逐渐改善,以阐明平山病是否存在“自限性”。
2.1 患者信息
本研究共纳入11例健康志愿者(男性8例,女性3例;年龄范围21-35岁;身高范围156-180厘米)和64例HD患者(男性63例,女性1例;年龄范围16-26岁:身高范围160–184厘米)。在HD患者中,38例为单侧肌肉萎缩为主(平均持续时间:23.5个月),余26例患者均存在一定程度的双上肢肌肉萎缩(18例右侧症状更严重,8例左侧症状更严重)。患者病程3-86个月(平均:23.5个月);其中11例患者病程≥4年。根据病程,将患者分为5组:≤1年(G1),1-2年(G2),2-3年(G3),3-4年(G4)和≥4年(G5)。
所有患者均在2011年1月至2014年3月期间于华山医院脊柱外科中心接受治疗。
HD纳入标准如下:
(1)疾病发作早于25岁;
(2)起病隐匿,病程进展持续(1至5年);
(3)患者有不对称的上肢无力或远端肌萎缩并且无合并感觉障碍;
(4)患者可能合并有以下临床症状:“冷瘫”和“伸指震颤”;
(5)神经电生理提示神经损害仅限于单侧或双侧上肢,主要涉及C7-T1段支配的肌节,且未检测到感觉神经的异常;
排除标准如下:
无运动神经元疾病,颈椎病,脊髓空洞症,脊髓肿瘤,颈椎畸形,多发性神经病,局灶性神经病,臂丛神经损伤,原发性肌营养不良,创伤,炎症,感染或其他可导致上述临床表现的疾病史。
2.2 检测方法
研究对象取仰卧位,行颈椎中立位、屈曲位MRI检测(颈椎屈45°并通过支具固定)。主要测量参数为:颈椎中立位与屈曲位情况下,C4-5、C5-6、C6-7与C7-T1各节段的颈脊髓后壁到椎管后壁的距离(X),颈椎管前后壁距离(Y),颈髓横断面前后径(A)和横径(B)(图1)。屈颈位中X/Y值代表“膜壁分离”的程度,颈椎中立位与屈曲位X/Y之差代表颈脊髓相对前移程度。屈颈位A/B则代表颈脊髓形变的程度。此外,对颈髓内存在异常信号的HD患者数目也被进行了记录。

图1:平山病患者颈脊髓横断面各项参数的测量方法
所有颈椎MRI检查均使用1.5 T Signa Excite MRI进行(GE Healthcare,密尔沃基,美国威斯康星州),磁场的中心设置在C6(扫描平面线平行于各节段椎间盘)。应用了常规的自旋回波序列扫描以获得T1加权和T2加权的横断面图像:(1)T1加权参数为TR/TE=480ms/9.2ms,ST=3.0mm以及512*512扫描矩阵;(2)T2加权参数为TR/TE=2700ms/122.7ms,ST=3.0 mm,512*512,FOV=32cm
2.3 数据分析
该研究使用SPSS12.0进行统计分析(SPSS,美国伊利诺伊州芝加哥)。使用方差分析(ANOVA)和Kruskal-Wallis检验分析各分组中相关参数的差异。P<0.05被定义为具有统计学意义。
所有研究对象参数列于表1内。在健康志愿者中,未发现颈椎中立位和屈曲位记录的各参数存在统计学差异(P>0.05)。在颈椎中立位时,各患者组(G1-G5)的相关参数与正常人相比无统计学差异(P>0.05),且在各患者组(G1-G5)之间,上述参数也均不存在明显统计学差异(P>0.05)。
相对于颈椎中立位X/Y值,在G2-G5组的C4-5节段,屈颈后观察到明显X/Y值增加;上述测量值异常增加也出现在所有患者组(G1-G5)的C5-6及C6-7节段(图2,P<0.05)。而在C7-T1节段,屈颈后X/Y值的明显增加,仅发生在病程超过4年的患者中(G5组)。此外,屈颈位X/Y值在5组患者间(G1-G5)也存在显著差异(P=0.022,图3)。
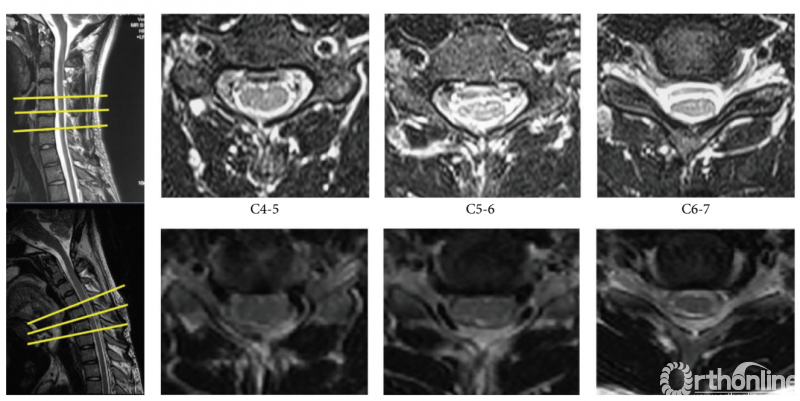
图2:1例18岁男性平山病患者,T2加权矢状位和横断面图像显示屈颈后出现明显“膜壁分离”现象

图3:各组平山病患者颈椎屈曲后平均X/Y

图4:各组平山病患者颈椎中立位与屈曲位X/Y的差值
颈椎中立位与屈曲位X/Y之差在5组患者间存在显著统计学差异(P=0.030;图4);更为重要的是,图3与4提示上述差异可能随病程明显加重。颈椎屈曲位MRI中,颈椎X/Y值在C4-5,C6-7和C7-T1并无显著差异(P>0.05)。相应的各节段颈髓对应的A/B在每组间也无统计学差异(P>0.05)。此外,A/B在各患者组间(G1-G5)也无明显统计学差异(P>0.05)。
不同于之前的研究,本次研究证实屈颈位X/Y值以及颈椎中立位与屈曲位X/Y之差并未随着病情进展而逐渐减少,提示平山病相关致病因素并不会随着病情进展而逐渐消失。更为重要的是,这项研究证实屈颈后“膜壁分离”现象较常见于C5-6、C6-7脊柱骨性节段,相对应的颈脊髓节段即是平山病最常涉及的C7-T1,这更一步确定了影像学特征和HD发病因素的关系。
随着病情的进展,C4-5脊柱节段也逐渐出现“膜壁分离”现象,并且只有在病程超过4年的患者中才能观察到C7-T1脊柱节段出现“膜壁分离”现象。上述发现也解释了病程较长的平山病患者会随着病程进展,由上肢远端肌肉逐渐累计三角肌,胸锁乳突肌和胸大肌等近端肌肉的现象[11,13]。
在本次研究中,只有10.9%的HD患者出现了屈颈后颈脊髓显著的形态学“变扁”表现,即A/B值异常。在2010年,Lai等学者提出,相对于颈椎屈曲后的颈髓前移,通过颈髓“变扁”来诊断HD更为可靠。可惜的是,他的文章仅涉及3名HD患者。Li等的研究进一步证实病程较长的平山病患者更有可能出现颈脊髓变细[6];此外形态学变化也受到某些因素如压迫的程度及椎管直径的限制。
上述原因解释了为什么本研究中较少观察到脊髓“变扁”现象。此外,颈髓整体变细也限制了我们在平山病患者中发现脊髓“变扁”现象。因此,“膜壁分离”可能仍然是目前诊断平山病较为可靠的影像学标准。
平山病的“自限性”除了归因于影像学变化外,部分学者认为通过观察萎缩肌肉是否存在自发电位也可以明确平山病是否“自限”[9,15];Misra和Kalita等指出当萎缩肌肉无自发电位时,平山病即发生了“自限”[15]。这些观点为平山病“自限性”从神经功能学的角度提供了理论基础。
然而,检测肌肉的自发电位消失并不能表明神经损伤已经完全停止,因为当肌肉去神经支配的速度慢于侧枝支配的速度时,尽管损伤依然在持续进展,但却无法自检测肌肉发现自发电位。这种情况在脊柱退变性疾病的颈椎或腰椎神经根损伤中最为常见。
在这项研究中,图3-4提示C4-5,C5-6和C6-7通常具有最显著的脊髓前移。虽然在病程超过4年后仍有持续进展,G4-G5组的斜率较前显著减少,提示膜壁分离程度随病情进展而加重的速度会逐渐减慢,且上述减慢通常发生在“膜壁分离”程度达到椎管直径40%时。
Cerami等人的研究也证实当“膜壁分离”达到一定程度时,颈髓会发生萎缩;随后,颈髓萎缩导致血管压迫消失,从而使得平山病自限[9];因此可以将“膜壁分离”达到椎管直径的40%作为极限值。
但是,图3-4同时显示C7-T1的相关参数在病程超过4年的患者中出现急速增加,提示当“膜壁分离”在某一节段达到极限值时,尽管该节段的影像学异常进展减缓,但与致病因素相关的“膜壁分离”现象会向相邻节段延伸。这个现象也解释了为什么许多患者在经历了平台期后会再次出现病情进展,并且主要表现在前臂,肩部,胸部甚至椎旁肌肉等区域。
应用横断面研究设计是本研究的一大重要局限。个体差异的出现可能显著影响实验结果。然而,HD是一种罕见病;当患者寻求治疗时他们通常都已经具有严重的上肢肌肉萎缩或者已经进入疾病的平台期,使得进行纵向研究十分困难。在未来的研究中,我们将继续收集早期确诊的平山病病例,以便开展设计更为良好的纵向研究。
总之,该项研究确认了“膜壁分离”依然是诊断平山病最为敏感和可靠的影像学指标。更为重要的是,随着平山病进展,上述与致病因素密切相关的影像学异常并不会随着病程进展而逐渐减少。此外,尽管在每一节段“膜壁分离”的程度是有限的,但随病程进展,“膜壁分离”现象可能会向相邻节段扩展。因此,对于平山病患者,积极的治疗干预以终止“膜壁分离”现象的进展是非常必要的。
作者简介

邵明昊
邵明昊,主治医师,医学博士,2016年毕业于复旦大学上海医学院临床医学专业,现复旦大学附属华山医院工作,复旦大学上海医学院博士在读,方向为脊柱外科。
以第一作者发表学术论文6篇,其中SCI收录期刊论文3篇。作为参与人完成课题4项,作为主持人完成课题2项。
多次参加国内外学术会议交流,获“海上精研”脊柱外科青年医生文献精读比赛一等奖,“上海脊柱晨光行动”“晨光讲者”称号,第二届全国脊柱脊髓基础研究论文比赛优秀奖,中华医学会第二十届骨科学术会议“中青年优秀论文三等奖”,上海市骨科学术年会论文二等奖。

吕飞舟
吕飞舟,主任医师,教授,博士生导师,复旦大学附属华山医院副院长兼骨科副主任,复旦大学附属上海市第五人民医院院长,复旦大学华山(国际)应用解剖研究与培训中心(PARTI)副主任。
担任中国康复医学会脊柱脊髓专业委员会脊柱脊髓损伤与康复学组委员,中国康复医学会脊柱脊髓专业委员会腰椎研究学组委员,上海市医学会骨科专科分会微创学组委员,中华医学会骨科学分会微创外科学组委员,上海市医学会骨科专科分会委员兼秘书,上海市康复医学会脊柱脊髓损伤专业委员会副主任委员,SICOT中国学会上海分会脊柱组副组长,《中国骨与关节杂志》通讯编委。
对脊柱疾病的诊治有较高的造诣,主持高难度和高风险的脊柱手术。协助创办脊柱应用解剖与手术技术学习班,成为业界极具影响力的教学新模式。作为第二完成者,参与完成的《基于国人解剖学研究的腰椎退变性疾病诊疗关键技术优化与推广应用》荣获上海市医学科技一等奖。主编《脊柱应用解剖图谱》(获新闻出版总署原创图书出版工程)。获得上海市闵行区“领军人才”奖励。
参考文献:
1. Hirayama K, Toyokura Y, Tsubaki T. Juvenile muscular atrophy of unilateral upper extremity: a new clinical entity [in Japanese] Psychiatr Neurol Jpn, 1959, 61(2): 2190-2197.
2. Hirayama K, Tomonaga M, Kitano K, et al. The first autopsy case of “juvenile muscular atrophy of unilateral upper extremity”. Shinkei Naika(Neurol Med), 1985, 22(2):85-86.
3. Hirayama K. [Juvenile muscular atrophy of unilateral upper extremity (Hirayama disease)--half-century progress and establishment since its discovery. Brain and nerve= Shinkei kenkyu no shinpo, 2008, 60(1): 17-29.
4. Kohno M, Takahashi H, Yagishita A, et al. ‘‘Disproportion theory’’ of the cervical spine and spinal cord in patients with juvenile cervical flexion myelopathy. A study comparing cervical magnetic resonance images with those of normal controls. Surg Neurol. 1998;50:421–430.
5. Sonwalkar HA, Shah RS, Khan FK, et al. Imaging features in Hirayama disease. Neurol India 2008;56(1):22–26.
6. Gandhi D, Goyal M, Bourque PR, Jain R. Hirayama disease. Radiology. 2004;230:692–696.
7. Huang YC, Ro LS, Chang HS, et al. A clinical study of Hirayama disease in Taiwan. Muscle & nerve, 2008, 37(5): 576-582.
8. Tashiro K, Kikuchi S, Itoyama Y, et al. Nationwide survey of juvenile muscular atrophy of distal upper extremity (Hirayama disease) in Japan.Amyotroph Lateral Scler. 2006;7:38-45.
9. Li Y, Remmel K. A case of monomelic amyotrophy of the upper limb: MRI findings and the implication on its pathogenesis. Journal of clinical neuromuscular disease, 2012, 13(4): 234-239.
10. Ciceri EF, Chiapparini L, Erbetta A, et al. Angiographically proven cervical venous engorgement: a possible concurrent cause in the pathophysiology of Hirayama’s myelopathy. Neurol Sci. 2010;31:845–848.
11. Boelmans K, Kaufmann J, Schmelzer S, et al. Hirayama disease is a pure spinal motor neuron disorder-a combined DTI and transcranial magnetic stimulation study. Journal of neurology, 2013, 260(2): 540-548.
12. Cerami C, Valentino F, Piccoli F, et al. A cervical myelopathy with a Hirayama disease-like phenotype. Neurological Sciences, 2008, 29(6):451-454.
13. Lai V, Wong YC, Poon WL, et al. Forward shifting of posterior dural sac during flexion cervical magnetic resonance imaging in Hirayama disease: An initial study on normal subjects compared to patients with Hirayama disease. European journal of radiology, 2011, 80(3):724-728.
14. Chen CJ, Chen CM, Wu CL, Ro LS, Chen ST, Lee TH. Hirayama disease: MR diagnosis. AJNR Am J Neuroradiol, 1998, 19:365–368.
15. Baba Y, Nakajima M, Utsunomiya H, et al. Magnetic resonance imaging of thoracic epidural venous dilatation in Hirayama disease. Neurology, 2004, 62:1426–1428.
16. Guo XM, Qin XY, Huang C. Neuroelectrophysiological characteristics of Hirayama disease: report of 14 cases. Chin Med J (Engl), 2012, 125: 2440-2443.
17. Wang XN, Cui LY, Liu MS, et al. A clinical neurophysiology study of Hirayama disease. Chin Med J (Engl), 2012, 125(6): 1115-1120.
18. Yavuz H. A proposal for the definition of Hirayama disease and monomelic amyotrophy. J Child Neurol., 2012, 27(6):815-816
19. Misra UK, Kalita J. Central motor conduction in Hirayama disease. Electroencephalography and Clinical Neurophysiology/Electromyography and Motor Control, 1995, 97(2): 73-76.
相关阅读: