作者:邹海波
来源:中日友好医院
《原发性骨质疏松症诊疗指南》是由中华医学会骨质疏松和骨矿盐疾病分会制定的关于原发性骨质疏松症的风险评估、诊断、治疗等等的行业标准,极大促进了临床医生骨质疏松症及相关疾病的规范诊疗。
该指南每五年修订一次,2022年由章振林主任委员牵头制定,相较2017版,2022版指南有10项更新、7项新增。
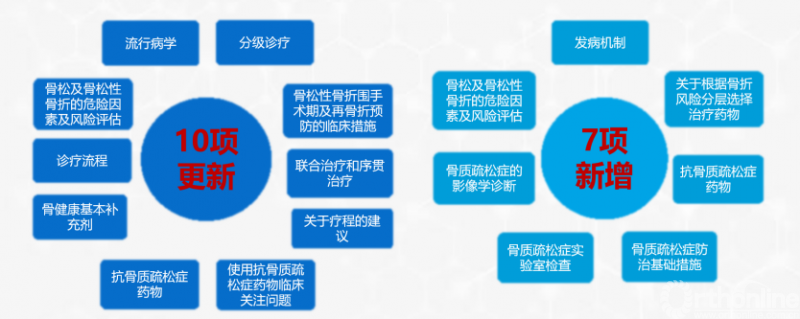
围绕以上更新和新增的内容,本文将进行分别阐述,详见下文。
一、骨质疏松症的概述和发病机制
骨质疏松症(Osteoporosis)是一种以骨量低下,骨组织微结构损坏,导致骨脆性增加,易发生骨折为特征的全身性骨病。骨质疏松症可发生于任何年龄,但多见于绝经后女性和老年男性。
本指南主要针对原发性骨质疏松症,即绝经后骨质疏松症(Ⅰ型),老年骨质疏松症(Ⅱ型)和特发性骨质疏松症(青少年型)。
1. 流行病学
中国60岁以上人口为2.64亿(约占总人口的18.7%),65岁以上人口超过1.9亿(约占总人口的13.5%),是全球老年人口最多的国家;全国骨质疏松症流行病学调查显示:50岁以上人群骨质疏松症患病率为19.2%,其中女性为32.1%,男性为6.9%;65岁以上人群骨质疏松症患病率为32%,其中女性为51.6%,男性为10.7%。根据以上流行病学资料估算,目前我国骨质疏松症患病人数约为9千万,其中女性约7千万。
相较于2017版指南中,50岁以上人群中女性骨质疏松患病率为20.7%,女性骨质疏松症患病率明显增高(在50岁以上人群中上涨了11.4%),成为尤为突出的问题。
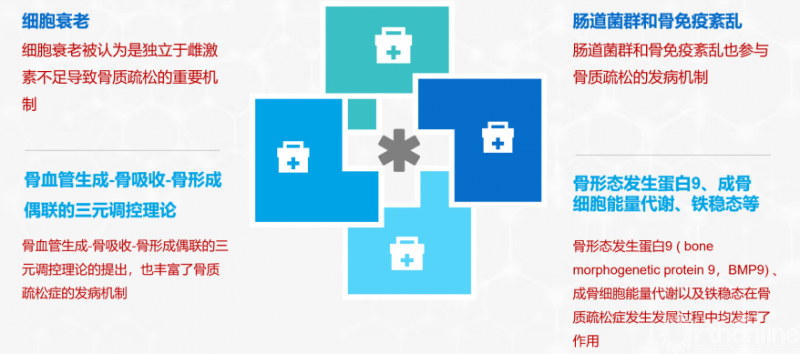
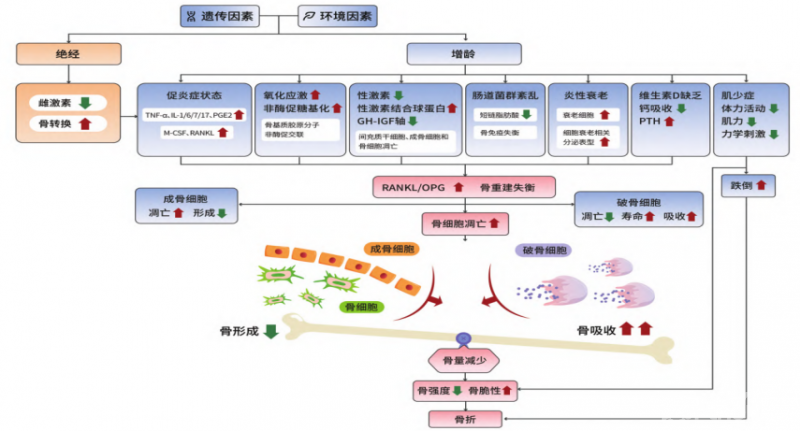
2. 发病机制
二、骨质疏松症的危险因素、风险评估等
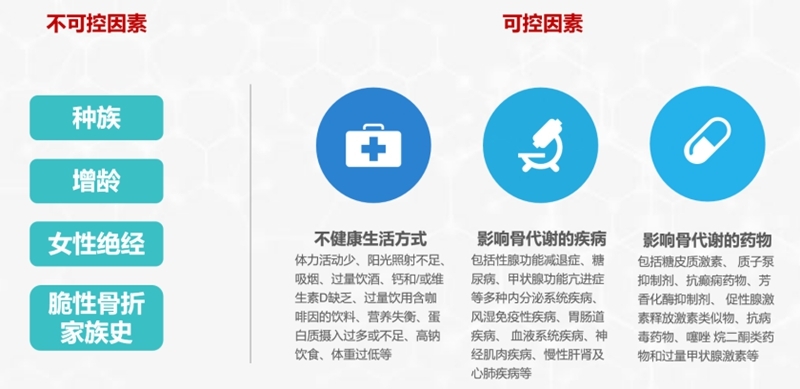
1. 骨质疏松症的危险因素
2. 骨质疏松症的风险评估工具
(1)IOF骨质疏松症风险一分钟测试题,用于疾病风险初筛。

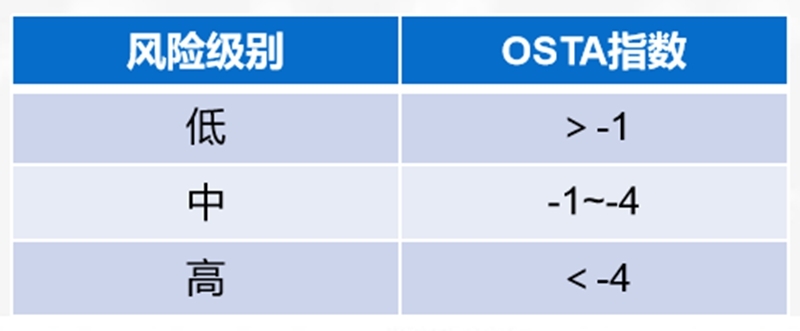
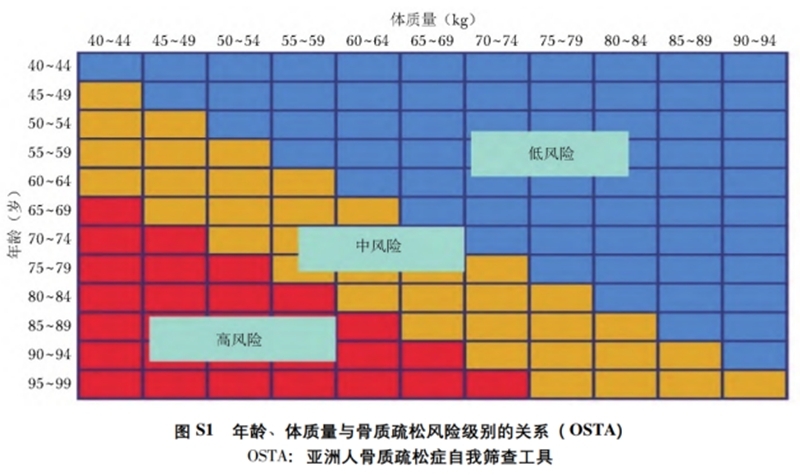
(2)亚洲人骨质疏松症自我筛查工具(OSTA)用于疾病风险初筛,仅适用于绝经后女性。
计算方法:指数=[体重(kg)-年龄(岁)]×0.2,结果评定见下表。也可以通过简图根据年龄和体重进行快速初步风险评估。
3. 骨质疏松性骨折的危险因素
(1)低骨密度
绝经后骨质疏松症患者,依据测量部位不同,骨密度每降低一个标准差,骨折风险增加1.5~2.0倍。低骨密度可以解释约70%左右的骨折风险。
(2)既往脆性骨折史
既往骨折发生次数越多,后续发生骨折的风险越大。特别是患者在初次骨折1~2年内,发生再骨折的风险显著升高,因此骨折发生后1~2年内再骨折的风险被称作“迫在眉睫的骨折风险”,其再骨折风险增加1.7 ~4.3倍。
(3)跌倒及其危险因素
跌倒是骨折的独立危险因素。我国不同地区老年人的跌倒发生率约为10.7%~20.6%,老年人跌倒后骨折发生率约为1/3。
(4)其他
除上述危险因素外,所有可引起骨质疏松症的危险因素均为骨折的危险因素。
糖皮质激素、过量饮酒等是独立于骨密度外预测OP性骨折风险的因素;40岁以上人群中,低股骨颈骨密度、超重、饮酒、长程使用糖皮质激素(>3个月)、从坐位到站立费时长均是OP性骨折的危险因素;而高龄、体力活动少、握力低、腰痛等也是椎体骨折的危险因素。
4. 骨质疏松性骨折的风险评估
FRAX是世界卫生组织(WHO)推荐的用于评估患者未来10年髋部及主要骨质疏松性骨折(椎体、前臂、髋部或肱骨近端)概率的骨折风险预测工具。
适应人群和流程: 具有一个或多个骨质疏松性骨折临床危险因素且未发生骨折的骨量减少患者,可通过FRAX计算未来10年发生髋部骨折及主要骨质疏松性骨折的概率。
FRAX的局限性:
(1)缺少我国的大样本流行病学数据,FRAX可能低估了国人的骨折风险;
(2)用于计算骨折风险的危险因素并不完善,如跌倒、糖尿病等重要因素未纳入其中;
(3)没有涉及糖皮质激素的用量及疗程,也没有纳入可导致骨量丢失的多种其他药物;
(4)没有考虑危险因素与骨折风险之间的 “量效关系”,包括既往骨折数目、既往骨折发生时间等。

三、骨质疏松症的表现、诊断、检查
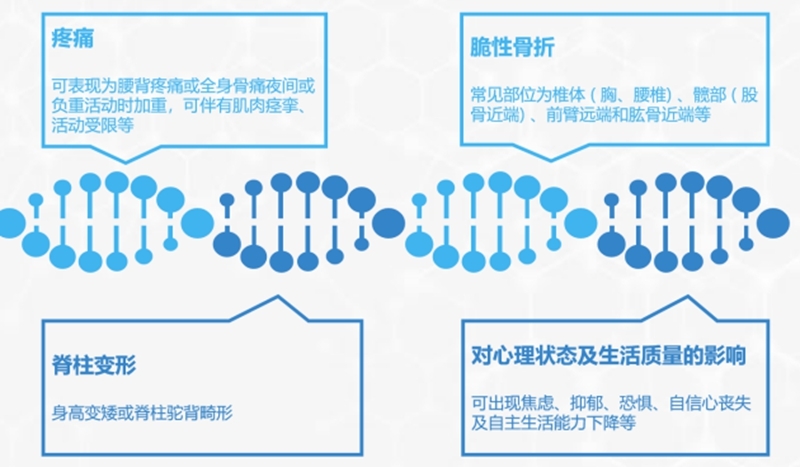
1. 骨质疏松症的临床表现
2. 骨质疏松症的影像学检查
(1)X线平片
是检出脆性骨折,特别是胸、腰椎压缩性骨折的首选方法;基于胸、腰椎侧位X线影像,目前采用Genant目视半定量判定方法。
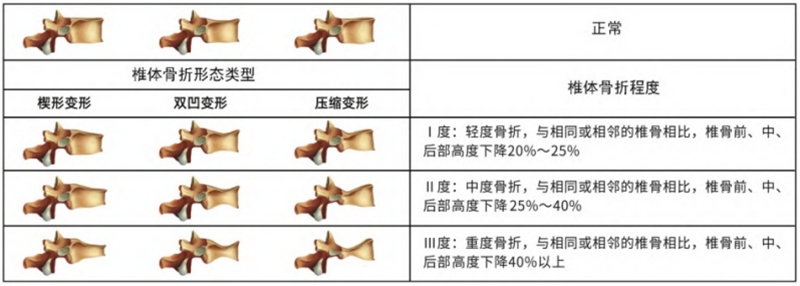
建议患者存在以下情况时,行胸、腰椎侧位X线或双能X线吸收检测法(DXA)侧位椎体骨折评估(VFA),以了解是否存在椎体骨折;2022版指南男性进行椎体骨折评估的指征更严格。

3. 骨质疏松症的影像学检查
新版指南中纳入了以下两类影像学检查:
(1)CT和MRI
CT和MRI可更为敏感地显示细微骨折,MRI显示骨髓早期改变和骨髓水肿更具优势;CT和MRI对于骨质疏松症与骨肿瘤等多种其他骨骼疾病的鉴别诊断具有重要价值。
(2)核医学检查
放射性核素显像在鉴别继发性骨质疏松症和其他骨骼疾病中具有一定优势,甲状旁腺功能亢进、畸形性骨炎、骨纤维结构发育不良、骨软化症、肿瘤骨转移等疾病的骨显像具有特征性的改变;PET-CT和 PET-MRI对骨质疏松症鉴别诊断,尤其是排查肿瘤相关骨病,具有一定的应用价值。
4. 骨密度及骨测量
(1)DXA检测骨密度
临床和科研最常用的骨密度测量方法,可用于骨质疏松症的诊断、骨折风险性预测和药物疗效评估。主要测量部位是中轴骨(腰椎和股骨近端),如果腰椎或股骨近端无法行骨密度检测,或对于患有甲状旁腺功能亢进症或接受雄激素剥夺治疗前列腺癌等患者,可以取非优势 侧桡骨远端1/3处作为测量部位。
(2)定量CT
椎体QCT骨密度低于80mg/cm3、介于80~120mg/cm3和高于120mg/cm3分别相当于WHO推荐骨质疏松症诊断标准中的骨质疏松、骨量减少和骨量正常。对于肥胖、脊柱退变或腹主动脉钙化等患者,QCT检测骨密度更为准确。
(3)外周骨密度测量
包括pQCT、pDXA、SXA及放射吸收法(RA)等,主要反映的是皮质骨骨密度,不能用于骨质疏松症的诊断,仅用于骨质疏松风险人群的筛查和骨质疏松性骨折的风险评估。
(4)定量超声
通常测量部位为跟骨,便携且无辐射,可用于骨质疏松风险人群的筛查和骨质疏松性骨折的风险评估,但不能用于骨质疏松症的诊断和药物疗效评估。
(5)骨小梁分数
是DXA衍生的一个新指标,为一种基于DXA图像的灰阶结构指数。作为骨密度的有益补充,提供骨密度以外的信息,可用于评估骨骼微观结构,不建议用于治疗药物的推荐以及作为骨吸收抑制剂疗效的监测指标。
5. 骨质疏松症的实验室检查
(1)一般检查项目
血常规、尿常规、血沉、肝和肾功能,血钙、血磷、血碱性磷酸酶、25-羟维生素D(25-hydroxyvitamin D,25OHD)和甲状旁腺素(parathyroid hormone,PTH)水平,以及尿钙、尿磷和尿肌酐等。
(2)骨转换生化标志物
骨转换过程中产生的中间代谢产物或酶类,称为骨转换生化标志物(bone turnover markers,BTMs)。骨形成标志物反映成骨细胞活性及骨形成状态,骨吸收标志物反映破骨细胞活性及骨吸收水平。推荐血清P1NP和CTX 分别为反映骨形成和骨吸收敏感性较高的标志物,原发性骨质疏松症患者的BTMs水平通常正常或轻度升高。
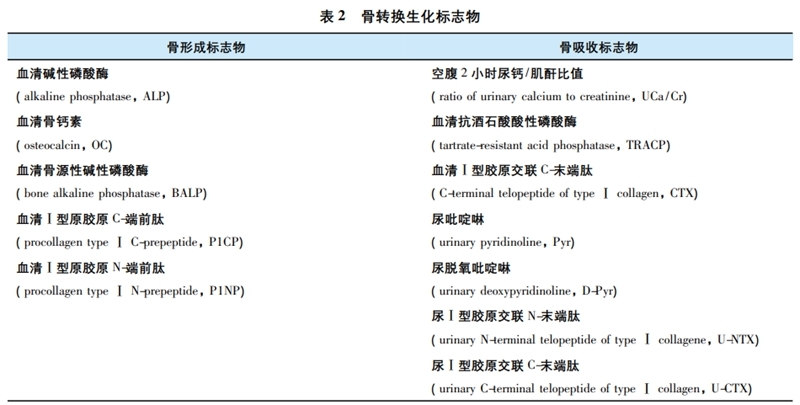
(3)用于鉴别诊断的实验室检查
原发性骨质疏松症患者通常血钙、磷和碱性磷酸酶值在正常范围,BTMs 水平也仅有轻度升高。若BTMs水平显著升高,需排除高转换型继发性骨质疏松症或其他代谢性骨病的可能性,如甲状旁腺功能亢进症、畸形性骨炎及恶性肿瘤骨转移等。
酌情检查项目:C-反应蛋白、性腺激素、血清泌乳素、甲状腺功能、24小时尿游离皮质醇或小剂量地塞米松抑制试验、血气分析、尿本周蛋白、M蛋白、血/尿轻链,甚至放射性核素骨扫描、骨髓穿刺或骨活检等检查。
6. 骨质疏松症的诊断
在详细的病史采集、体格检查、骨折风险评价、骨密度测量,以及影像学和实验室检查后:

7. 骨质疏松症的鉴别诊断
在诊断原发性骨质疏松症之前,一定要重视和排除其他影响骨代谢的因素,以免发生漏诊或误诊。
需要鉴别的病因主要包括: 影响骨代谢的内分泌疾病(甲状旁腺疾病、性腺、肾上腺、甲状腺疾病等)、类风湿关节炎等自身免疫性疾病、影响钙和维生素D吸收和代谢的消化道和肾脏疾病、神经肌肉疾病、多发性骨髓瘤等恶性疾病、多种先天和获得性骨代谢异常疾病以及长期服用糖皮质激素或其他影响骨代谢药物等。
8. 骨质疏松症的诊疗流程
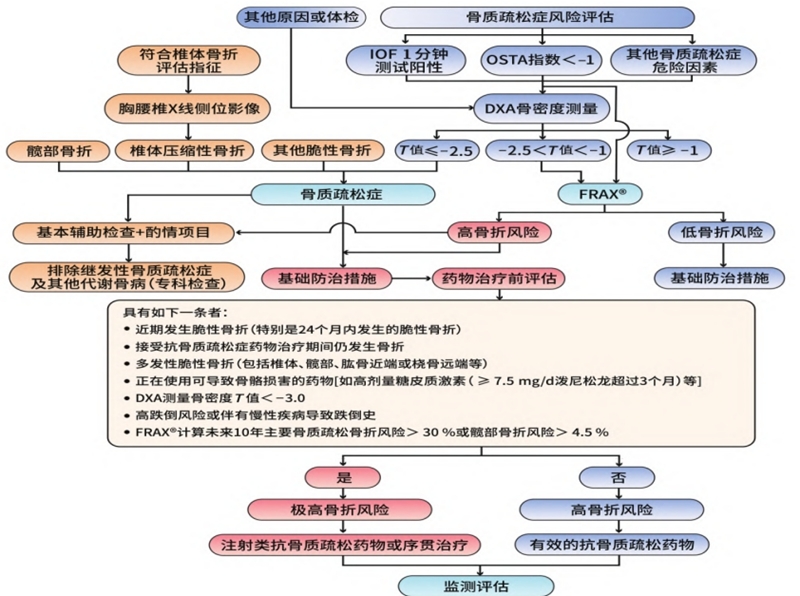
2022版指南将骨质疏松症患者分为高骨折风险和极高骨折风险两类进行管理;2017版按照低、中、高风险进行管理。
四、骨质疏松症的防治
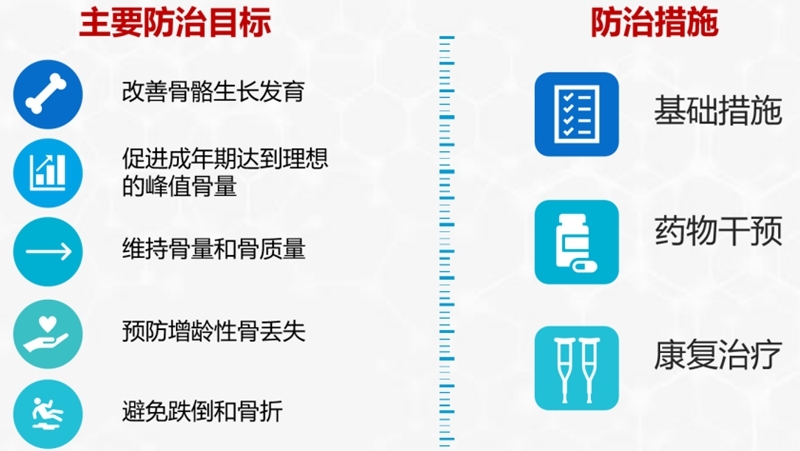
1. 基础措施
(1)调整生活方式

(2)骨健康基本补充剂

2. 药物干预

(1)骨吸收抑制剂(双膦酸盐类)
双膦酸盐(bisphosphonates)是目前临床上应用最为广泛的抗骨质疏松症药物,是焦磷酸盐的稳定类似物,其特征为含有P-C-P基团,与骨骼羟基磷灰石具有高亲和力,能够特异性结合到骨重建活跃部位,抑制破骨细胞功能,从而抑制骨吸收。
目前用于防治骨质疏松症的双膦酸盐类药物主要包括如下几种:

双膦酸盐类药物总体安全性较好:

(2)其他骨吸收抑制剂

(3)促骨形成药、双重作用药、其它类

(4)根据骨折风险分层选择治疗药物
高骨折风险
符合骨质疏松症诊断的患者均属于高骨折风险者,初始药物可选择阿仑膦酸钠、利塞膦酸钠等;若口服药物不耐受,可选择唑来膦酸或地舒单抗。
极高骨折风险
骨质疏松症患者合并以下任意一条危险因素,均属于极高骨折风险者:
近期发生脆性骨折(特别是24个月内发生的脆性骨折);
接受抗骨质疏松症药物治疗期间仍发生骨折;
多发性脆性骨折(包括椎体、髋部、肱骨近端或桡骨远端等);
正在使用可导致骨骼损害的药物如高剂量糖皮质激素(≥7.5 mg/d泼尼松龙超过3个月)等;
DXA测量骨密度T-值<-3.0;
高跌倒风险或伴有慢性疾病导致跌倒史;
FRAX计算未来10年主要骨质疏松骨折风险>30%或髋部骨折风险>4.5%。
对于极高骨折风险的患者,初始药物可选择特立帕肽、唑来膦酸、地舒单抗、罗莫佐单抗;对于髋部骨折极高风险患者,建议优先选择唑来膦酸或地舒单抗。
(5)抗骨质疏松症药物的疗程建议
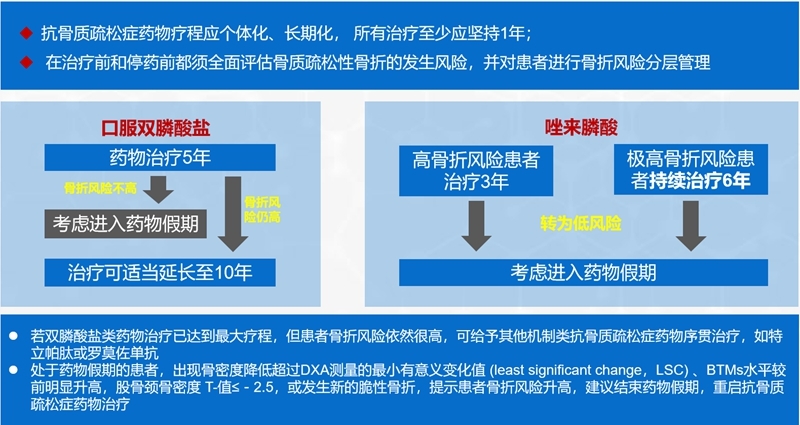
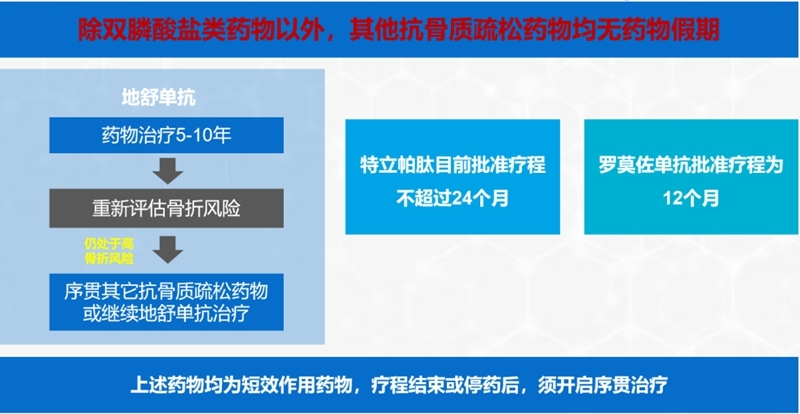
(6)抗骨质疏松症药物的联合和序贯治疗
骨质疏松症属于患病率高、危害严重的慢性疾病,需要采取多种有效药物进行长期的联合或序贯治疗,以增加骨密度,降低骨折风险;不同作用机制的药物是否能够联合使用,取决于循证医学证据,还应充分考虑药物经济学的影响;治疗方案须根据患者骨折风险分层、临床情况进行个体化选择。
联合治疗方案:
钙剂与维生素D作为基础治疗药物,可以与骨吸收抑制剂或骨形成促进剂联合使用;
不建议联合使用相同作用机制的抗骨质疏松症药物;
如果使用降钙素以缓解疼痛,可短期与其他抗骨质疏松症药物联合使用。
以下情况需要考虑序贯治疗方案:
某些骨吸收抑制剂治疗失效、疗程过长或存在不良反应时;
骨形成促进剂(PTH类似物等)的推荐疗程已到,但患者骨折风险仍高,需后续继续治疗者;
特立帕肽(最多使用24个月)或地舒单抗等短效作用药物停药之后,须维持治疗效果者。
不同作用机制药物的序贯治疗:
特立帕肽序贯双膦酸盐类药物或地舒单抗治疗可有效增加骨密度,降低骨折风险,是较为合适的序贯治疗模式;
地舒单抗序贯特立帕肽,腰椎骨密度短期(半年)下降, 股骨颈和全髋部骨密度1年之内持续下降,之后骨密度逐渐增加。可酌情作为骨吸收抑制剂使用时间过长,ONJ或AFF风险较高或已出现ONJ或AFF且仍处于骨折极高风险患者的替代治疗方案;
双重作用药物罗莫佐单抗序贯双膦酸盐类药物或地舒单抗,可有效维持或提高腰椎和髋部骨密度,降低椎体和非椎体骨折风险;
特立帕肽联合地舒单抗治疗后,序贯唑来膦酸治疗,可以明显增加股骨颈和全髋部骨密度。
相同作用机制药物的序贯治疗:
口服阿仑膦酸钠序贯唑来膦酸或者地舒单抗治疗,均可有效增加腰椎和全髋部骨密度;建议酌情用于口服双膦酸盐类药物无法耐受或效果不佳的高骨折或极高骨折风险患者;
地舒单抗序贯唑来膦酸,适用于地舒单抗不适当停药或者患者主观要求停药时的挽救方案,可极大程度避免因地舒单抗停药导致的骨量快速丢失及骨折风险升高。
(7)骨质疏松性骨折围手术期及再骨折预防的措施
经皮椎体后凸成形术(percutaneous kyphoplasty,PKP)和经皮穿刺椎体成形术(percutaneous vertebroplasty,PVP)均属于经皮椎体强化术(percutaneous vertebral augmentation,PVA),是目前首选的微创手术治疗方法。
中国专家共识或指南提出OVCF选择PVA应严格掌握如下适应证:
非手术治疗无效,疼痛严重;
椎体骨折不愈合或椎体内部囊性变、椎体坏死;
不宜长时间卧床或高龄患者。
OVCF微创手术治疗在国内应用较广泛,是否增加术后再骨折的发生率尚待证实;使用常规剂量的抗骨吸收药物,包括双膦酸盐类药物(口服或静脉)或地舒单抗等,对骨折愈合无明显不良影响;尽早开始抗骨质疏松症药物治疗是预防椎体再骨折的关键。
IOF 推荐开展骨折联络服务(fracture liaison service,FLS)管理项目
中华医学会骨质疏松和骨矿盐疾病分会联合中华医学会骨科学分会发表了《骨质疏松性骨折后再骨折防治专家共识》,均对 “再骨折预防的临床应对”提出了具体工作内容,主要包括:
医院逐步形成“再骨折防治”团队,管理骨折患者;
开展跌倒风险评估;
制定骨质疏松症治疗和随访方案、康复锻炼计划;
开展再骨折防治的科普教育。
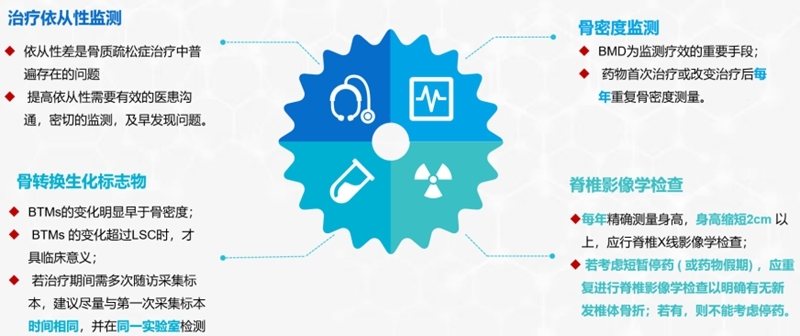
(8)抗骨质疏松症药物治疗期间的监测
3. 康复治疗

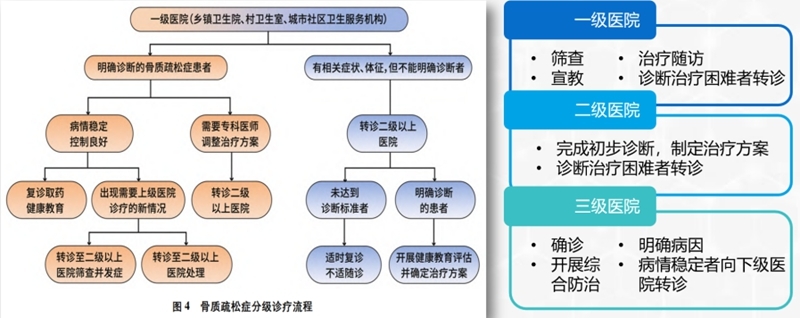
五、骨质疏松症的分级诊疗
骨质疏松症的分级诊疗,即按照疾病的轻、重、缓、急及治疗难易程度进行分级;不同级别的医疗机构承担不同疾病状况的治疗,实现基层首诊和双向转诊,以有效利用卫生资源,做好骨质疏松症的防控和管理,同时提高医疗卫生机构开展疾病预防控制的能力。

骨质疏松症分级诊疗流程及分工:
六、总结
(1) 骨质疏松症风险评估工具为IOF一分钟测试题与OSTA评分,阳性结果的患者应进行DXA检查进行诊断;
(2) 新增了低骨密度、脆性骨折史、糖皮质激素使用、过量饮酒等作为骨质疏松性骨折的独立危险因素,应对具有相关危险因素的患者进行骨松性骨折的筛查与诊治;
(3) 新增了QCT的骨密度诊断标准,为骨质疏松症的诊断提供了新思路;
(4) 发生髋部或椎体脆性骨折,不依赖于骨密度测定即可诊断骨质疏松症并开始治疗;
(5) 椎体骨折的评估首选X光片、要注意是否发生椎体形变,X光片不能确诊时可通过CT/MRI以更好的观察到细微骨折和骨髓水肿等,进行辅助诊断;
(6) 在骨质疏松症的诊疗方面强调了按照高骨折风险和极高骨折风险进行分层治疗、分层管理的重要性:
(7) 对于高骨折风险者,初始药物可选择阿仑膦酸钠、利塞膦酸钠等;若口服药物不耐受,可选择唑来膦酸或地舒单抗;
(8) 对于极高骨折风险的患者,初始药物可选择特立帕肽、唑来膦酸、地舒单抗、罗莫佐单抗;对于髋部骨折极高风险患者,建议优先选择唑来膦酸或地舒单抗;
(9) 口服双膦酸盐类药物使用5年、静脉双膦酸盐类使用3年可对患者骨折风险进行评估,若为低风险可进入药物假期,若为高风险,可再继续治疗一个疗程;
(10) 地舒单抗停药后需要序贯双膦酸盐类药物,特立帕肽停药后需要序贯抗骨吸收类药物(如双膦酸盐类);
(11) OVCF微创手术治疗后尽早开始抗骨质疏松症药物治疗是预防椎体再骨折的关键,应使用常规剂量的抗骨吸收药物,包括双膦酸盐类药(口服或静脉)物或地舒单抗等,对骨折愈合无明显不良影响;
(12) 不同层级医院之间进行分级诊疗、有序转折,可以促进患者合理就医、规范治疗,从而降低骨质疏松症及骨质疏松性骨折的发病率及死亡率。