吴莉1,赵娴2,何波1,陈泽谷3,陆林1,魏韩笑2,张承磊4,刘流2
昆明医科大学第一附属医院(昆明,650032)1 医学影像科,2 整形外科,4 血管外科;3 中南大学湘雅医学院附属海口医院放射科
炎症、外伤、肿瘤切除所致大面积骨缺损修复是临床难题,随着组织工程技术的发展,组织工程骨为骨缺损修复提供了新方法。组织工程骨的微血管化是骨组织工程研究的核心问题[1]。目前可通过加入促血管生成因子、改造支架结构等方法促进组织工程骨血管形成[2],但效果并不理想。内皮祖细胞(endothelial progenitor cells,EPCs)在体内外可分化为血管内皮细胞生成血管,且在特定微环境下可促进MSCs成骨[3]。因此,本研究拟将自体外周血来源的EPCs 与BMSCs直接共培养,体外复合至包被纤维粘连蛋白(fibronectin,FN)的部分脱蛋白生物骨(partially deproteinised bone,PDPB)支架上,并异位移植至兔四肢肌袋内,观察EPCs微血管化能力,旨在探讨EPCs在BMSCs成骨中的作用。
1 材料与方法
1.1 实验动物及主要试剂、仪器
6 月龄新西兰大耳兔9 只,体质量(2.5±0.5)kg,购自昆明医科大学动物科。
PDPB由本课题组自制[4]。H-DMEM培养基、L-DMEM培养基、15%FBS(HyClone 公司,美国);兔淋巴细胞分离液(Sigma 公司,美国);胰蛋白酶、Trizol(Takara 公司,日本);兔CD34、CD133、血管性血友病因子(von Willebrand factor,vWF)、CD29、CD90、CD105、紧密连接蛋白1(zonula occludens protein 1,ZO-1)一抗(北京博奥森生物科技有限公司);逆转录试剂盒(Thermo Fisher Scientific 公司,美国);荧光定量PCR试剂盒及引物设计(大连宝生物工程有限公司);Loading Buffer、DNA ladder(Fermantas公司,立陶宛)。细胞培养箱(Thermo Fisher Scientific 公司,美国);低温离心机(北京医用离心机厂);RT-PCR 仪(Bio-Rad 公司,美国);光学显微镜、倒置相差显微镜、荧光显微镜(Olympus 公司,日本);Leica Qwin 2.3 软件(Leica 公司,德国); Image-Pro plus 6.0 图像分析软件(Media Cybernetics 公司,美国)。
1.2 外周血EPCs 及BMSCs 共培养体系的建立
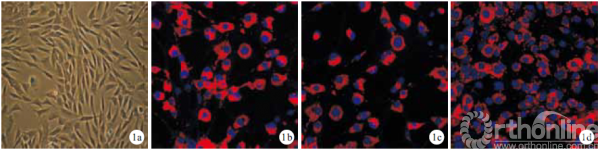
1.2.1 外周血EPCs 分离培养及鉴定 全身肝素化后抽取1~9号新西兰大耳兔耳中央动脉外周血5 mL,采用兔淋巴细胞分离液分离单核细胞,密度梯度离心法及贴壁法分离EPCs[5],同时标记第1~9号兔细胞;原代细胞生长至70% 融合时,以0.25% 胰蛋白酶消化,按1∶2 比例传代,倒置相差显微镜下观察细胞形态变化。取第3 代细胞行免疫荧光染色观察CD34、CD133、vWF 表达,DAPI 染核,甘油封片,荧光显微镜下观察。
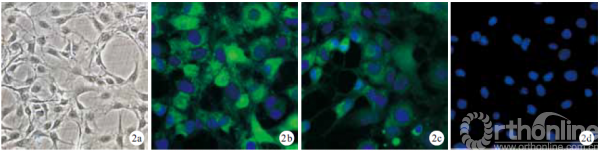
1.2.2 BMSCs 分离培养及鉴定 抽取第1~9 号新西兰大耳兔双侧胫骨、股骨肝素抗凝骨髓血5 mL,采用密度梯度离心法及贴壁法分离BMSCs[5],同时标记第1~9 号兔细胞。原代细胞生长至70% 融合时,以0.25% 胰蛋白酶消化,按1 ∶ 2 比例传代。取第3 代细胞行免疫荧光染色观察CD29、CD34、CD90表达,DAPI 染核,甘油封片,荧光显微镜下观察。
1.2.3 外周血EPCs 及BMSCs 共培养体系建立 将第3 代1 ~ 9 号兔BMSCs 加入成骨诱导分化培养基[6](含10%FBS、50 U/mL 青霉素、50 mg/ mL链霉素、100 nmol/L 地塞米松、10 mmol/L β- 甘油磷酸钠、50 μmol/L 维生素C 的H-DMEM 培养液),2 d 换液1 次。诱导7 d 后,均收集1.106 个细胞,加入0.5.106 个相同序号的第3 代EPCs ,即BMSCs ∶ EPCs=2 ∶ 1[5],加入前述成骨诱导分化培养基及成血管诱导分化培养基[7](含10%FBS、50 ng/ mL VEGF 及20 μg/ mL 牛脑垂体提取物的甲基纤维素半固体基础培养基)各半进行培养,即为1 ~ 9 号外周血EPCs 及BMSCs 共培养体系。
1.3 组织工程骨构建
1.3.1 生物支架准备 生物支架为本课题组预先制备的包被FN 的PDPB[4],大小为0.5 cm.0.5 cm.0.3 cm,于4℃冰箱储存备用。
1.3.2 组织工程骨构建 分别制备3 种复合不同细胞的组织工程骨。取出54 块PDPB,置于装有DMEM 的培养皿中预湿;于培养皿中分别加入混有20 μL PBS 的1 ~ 9 号兔来源的单纯EPCs、单纯BM SCs 及共培养细胞各1.106 个,分别构建A、B、C 3 种组织工程骨(n=18)。于37℃、5%CO2 及饱和湿度培养箱内培养4 h 后,分别置于96 孔板,C 组加成骨及成血管诱导分化混合培养基,A、B 组加成骨诱导分化培养基至总量100 μL,置37℃、5%CO2 及饱和湿度培养箱中培养,隔日换液。
1.4 动物体内移植实验
1.4.1 组织工程骨兔自体异位移植 取1 ~ 9 号新西兰大耳兔,水合氯醛(2 mL/kg)腹腔注射麻醉,分别于右上肢、左上肢、右下肢剃毛、消毒,皮肤、皮下分层切开,切开肌膜,钝性分离肌肉束,扩充1 cm.1 cm.1 cm 大小的肌袋。组织工程骨体外复合培养4 d 后,分别将1 ~ 9 号兔来源的A、B、C 3 种组织工程骨移植至同序号兔右上肢、左上肢、右下肢肌袋[8],每个肢体移植2 块组织工程骨。
1.4.2 大体观察 移植后2、4、8 周,随机取3 只兔,切开术区观察各组组织工程骨生长情况。
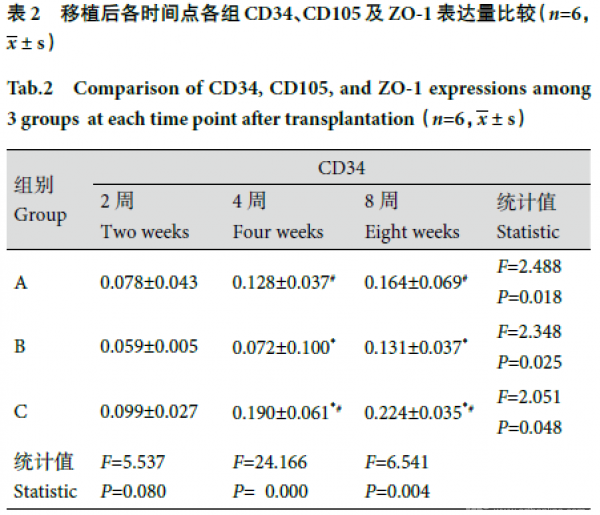
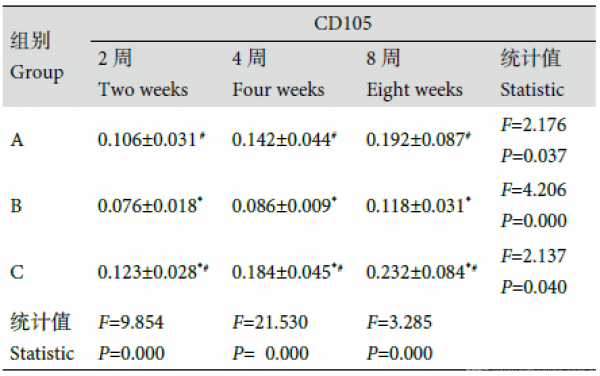
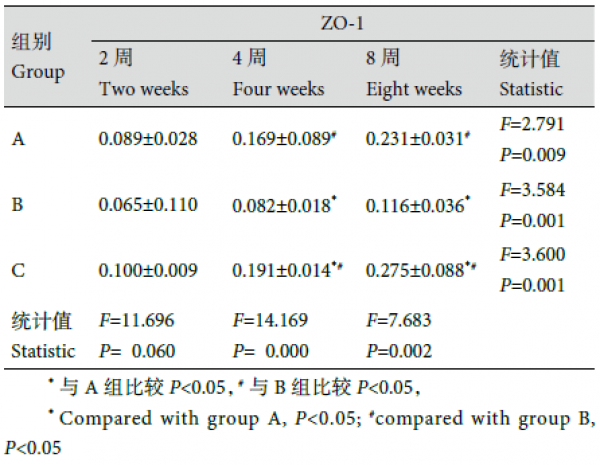
1.4.3 组织学及免疫组织化学染色观察 大体观察后取各组组织工程骨,于4% 多聚甲醛固定,脱钙液脱钙、石蜡包埋组织切片,中心部分连续切片3 张,片厚0.5 μm。常规行HE 染色及CD34、CD105、ZO-1 免疫组织化学染色,光镜下观察。每张HE 染色切片随机取3 个视野,采用Leica Qwin 2.3 软件分析成骨面积,按以下公式计算骨长入率:(骨长入区域面积/植入物区域面积).100%;采用Image-Pro Plus 6.0 图像分析软件分析免疫组织化学染色切片,得到阳性细胞平均吸光度(A)值,比较各组CD34、CD105、ZO-1 表达量变化。
1.5 统计学方法
采用SPSS19.0 统计软件进行分析。数据以均数±标准差表示,组间比较及组内各时间点间比较采用单因素方差分析,两两比较采用SNK 检验;检验水准α=0.05。
2 结果
2.1 外周血EPCs、BMSCs 形态学观察及鉴定
倒置相差显微镜观察示,外周血EPCs 培养14d 呈典型“铺路石”样外观,21d 细胞连接成片。第3 代细胞CD34、CD133、vWF 免疫荧光染色均为阳性。见图1。BMSCs 培养7 d 形成小型细胞集落;9 d 细胞集落数目增多,双核、梭形、纺锤形细胞螺旋状聚拢。第3 代BMSCs 免疫荧光染色CD29、CD90呈阳性,CD34 呈阴性。见图2。

2.2 动物体内移植实验
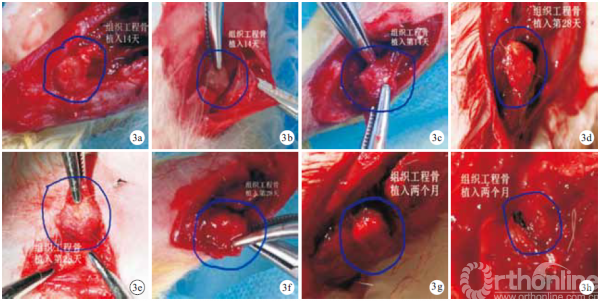
2.2.1 大体观察 移植后2 周,各组组织工程骨均被周围软组织包绕,C 组较A、B 组包绕紧密,局部不可分开;切开后各组切缘锐利,切面均可见组织工程骨原有孔隙,C 组切面边缘见少许鲜红软组织长入。4 周,各组包绕组织工程骨的软组织增多、增厚,C 组切缘见鲜红软组织进一步向孔隙内填充,B 组长入组织工程骨内鲜红软组织较少,A 组更少,各组均未见明确血管长入组织工程骨内。8 周,各组周围软组织与组织工程骨分界不清,组织工程骨边缘圆润;C 组切面大部分组织工程骨原有孔隙由鲜红软组织填充,可见迂曲小血管网长入组织工程骨中心,A、B 组组织工程骨中心仍有未被填充的原有孔隙。见图 3。
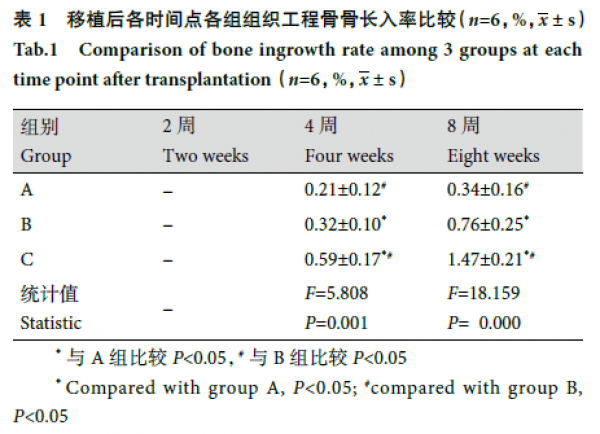
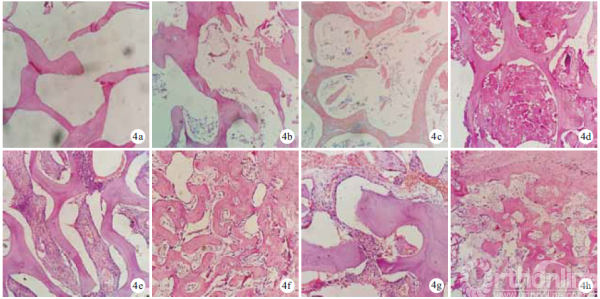
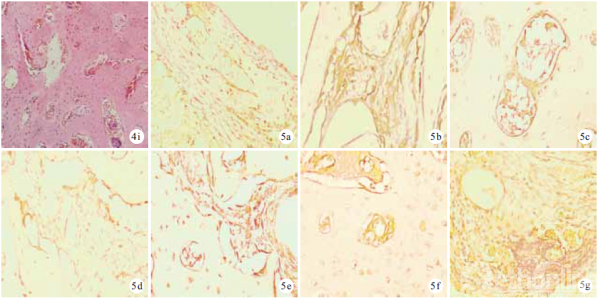
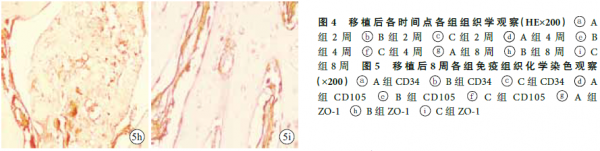
2.2.2 组织学观察 移植后2 周,各组组织工程骨内均见少量血管,管腔形成不明显,未见明显骨组织长入。4 周,各组组织工程骨内毛细血管逐渐形成管腔,A、C 组较明显;B、C 组可见胶原纤维生长,C 组更明显。8 周,各组可见毛细血管明显增多,管腔内出现红细胞,胶原纤维增多,可见骨小梁和新生骨,以C 组明显,其次为B 组。见图4。移植后4、8 周,C 组骨长入率显著高于A、B 组,B 组高于A 组,差异均有统计学意义(P<0.05)。见表1。
2.2.3 免疫组织化学染色观察 移植后2、4、8 周,随时间延长,3 组组织工程骨CD34、CD105、ZO-1表达量均逐渐增多,组内各时间点间比较差异均有统计学意义(P<0.05)。见表2。组间比较:移植后2 周,A、C 组见少许阳性细胞,B 组未见阳性细__胞;仅CD105 表达量3 组间两两比较差异有统计学意义(F=9.854,P=0.000);4、8 周,3 组间CD34、CD105、ZO-1 表达量两两比较差异均有统计学意义(P<0.05),C 组最多,B 组最少。4 周,A、C 组新生内皮细胞逐渐围成管腔形成新生血管,少量管腔内可见红细胞,B 组管腔形成不明显;8 周,C 组见明显新生血管管腔且部分与宿主血管沟通,A 组新生血管增多,B 组少许新生血管。见图5。
3 讨论
组织工程支架上的种子细胞只有在有氧代谢、细胞灌注充足、合理营养物质供应和代谢产物及时排出时才能存活[9-10];然而,种子细胞与支架材料复合移植后,周围宿主血管内营养物质的扩散深度仅约150 μm/h[11]。因此,寻找有效方法及时建立组织工程骨与宿主之间的有效血液循环,保证干细胞有持续营养物质供应,是干细胞存活的关键。
Martin 等[10]将EPCs 和BMSCs 采用Transwell小室间接共培养及两种细胞直接接触共培养进行比较,结果显示直接接触共培养的两种细胞成骨更明显,认为可能由于两种细胞的直接接触改变了共培养环境,促进了两种细胞之间的信号交流及生长因子分泌,从而促进了成骨。因此,本研究采用直接接触共培养方法,将按1 ∶ 2 比例共培养的自体外周血来源EPCs-BMSCs 及单纯培养的EPCs、BMSCs 分别复合于PDPB 上,同时自体移植至兔四肢肌袋内行异位体内诱导成骨培养,观察组织工程骨及周围组织的变化。移植8 周后,3 组组织工程骨支架均未出现排斥反应,且逐步降解,由胶原、骨小梁及新生骨替代。其中C 组组织工程骨成血管及成骨趋势最好,随时间延长至8 周时骨长入率为1.47%±0.21%,明显高于其余两组,与文献报道一致[12]。免疫组织化学染色观察示,移植后8 周C 组组织工程骨内新生血管明显增多,且部分与宿主血管沟通,见大量表达CD34、CD105、ZO-1 的血管内皮细胞,C 组各因子表达量均显著高于A、B 组。
本研究结果显示,将EPCs 与BMSCs 按1∶2比例共培养具有协同作用,促进了组织工程骨微血管化进程,增强了BMSCs 的成骨活性,与国外研究结果一致[13]。BMSCs 有高度自我更新及多向分化潜能,在体内外不同微环境下均可诱导分化为成骨细胞、成软骨细胞和破骨细胞[14],其在成骨过程中旁分泌多种可溶性细胞因子,如VEGF、粒细胞集落刺激因子(granulocyte colony-stimulating factor,G- CSF)、BMP-2 等,其中VEGF 可与EPCs 上的VEGF 受体特异性结合,活化受体细胞内段偶联的络氨酸激酶,催化下游信号蛋白,促使EPCs 增殖并定向内皮细胞分化,促进新生血管管腔形成[15],因此VEGF 是EPCs促进血管生成的最重要因子[16]。G-CSF 可通过提高VEGF 表达,提高外周血EPCs 增殖能力及归巢能力[17]。BMP-2 可由BMSCs 分泌,亦是EPCs 分泌的重要生长因子[18],可在移植后15 min 内促进MSCs成骨分化[19]。而EPCs 可明显提高BMSCs 的干性功能、增殖能力及成骨分化能力,温丽[20] 研究表明在EPCs 旁分泌因子的作用下,EPCs 还可提高BMSCs分泌VEGF 及BMP-2 等成骨、成血管因子,从而促进新生血管形成及新骨形成。
本研究采用免疫组织化学染色检测了各组组织工程骨中CD34、CD105、ZO-1 阳性细胞的表达,结果显示C 组组织工程骨移植后4 周即形成了血管管腔结构,并逐渐与周围软组织内血管沟通,形成功能性微血管(ZO-1 阳性),促进了营养物质输送,增加BMSCs 存活数量,提高其增殖和成骨分化能力。CD34 是血管内皮细胞特异性的标记物,能突出显示较小的不成熟微血管和单个内皮细胞,但成熟的血管内皮细胞CD34 也可表现为阳性;CD105 是新生血管特异性标记物,能突出显示新生血管,在研究肿瘤、组织工程移植物时广泛应用;ZO-1 是紧密连接蛋白,其表达表示血管为功能性血管,同时可见血管内红细胞,ZO-1 与CD105 同时表达即可认为新生血管为功能性血管,具有携带营养物质并带走代谢产物的功能[21]。本研究结果显示,移植2 周时3 组间ZO-1 表达量比较差异均无统计学意义,说明此时3 组均未生成功能性微血管,而移植后4、8 周,C 组ZO-1 表达量较其余两组均明显增加,生成了功能性微血管。
综上述,将EPCs 与BMSCs 联合培养可增加组织工程骨微血管网的形成及促进成骨,为自体细胞复合构建血管化组织工程骨提供了理论依据。但这两种细胞相互作用的确切分子机制尚未完全明确,有待于进一步研究。
4 参考文献
1 Li Q, Wang Z. Influence of mesenchymal stem cells with endothelial progenitor cells in co-culture on osteogenesis and angiogenesis: an in vitro study. Arch Med Res, 2013, 44(7): 504-513.
2 Schumann P, Lindhorst D, von See C, et al. Accelerating the early angiogenesis of tissue engineering constructs in vivo by the use of stem cells cultured in matrigel. J Biomed Mater Res A, 2014, 102(6):1652-1662.
3 Yamada A, Yokoo T, Yokote S, et al. Comparison of multipotency and molecular profile of MSCs between CKD and healthy rats. Hum Cell, 2014, 27(2): 59-67.
4 王福科,刘流,李彦林,等.骨髓基质干细胞与PDPB体外构建组织工程骨的适宜条件.中国组织工程研究与临床康复,2008,12(33):6401-6405.
5 赵娴.自体外周血EPCs与BMSCs联合PDPB构建微血管化生物骨.昆明:昆明医科大学,2013.
6 幸嵘,孔清泉,项舟,等.小鼠干细胞成骨和成软骨分化特异性微小RNA的初步研究.中国修复重建外科杂志,2014,28(8):1009-1016.
7 晏开力,汪健,李庆,等.成人骨髓间充质干细胞分化为血管内皮细胞的研究.中国修复重建外科杂志,2007,21(1):76-80.
8 Song X, Liu S, Qu X, et al. BMP2 and VEGF promote angiogenesis but retard terminal differentiation of osteoblasts in bone regeneration by up-regulating Id1. Acta Biochim Biophys Sin(Shanghai), 2011, 43(10): 796-804.
9 Lindhorst D, Tavassol F, von See C, et al. Effects of VEGF loading on scaffold-confined vascularization. J Biomed Mater Res A, 2010,95(3): 783-792.
10 Martin JR, Gupta MK, Page JM, et al. A porous tissue engineering scaffold selectively degraded by cell-generated reactive oxygen species. Biomaterials, 2014, 35(12): 3766-3776.
11 Ebrahim NA, Leach L. Temporal studies into attachment, VEcadherin perturbation, and paracellular migration of human umbilical mesenchymal stem cells across umbilical vein endothelial monolayers. Stem Cells Dev, 2015, 24(4): 426-436.
12 王伟,刘德红,李卓成,等.转染VEGF基因对内皮祖细胞生长的影响研究.中国实验诊断学,2015,19(3):355-358.
13 Menge T, Gerber M, Wataha K, et al. Human mesenchymal stem cells inhibit endothelial proliferation and angiogenesis via cell-cell contact through modulation of the VE-Cadherin/β-catenin signaling pathway. Stem Cells Dev, 2013, 22(1): 148-157.
14 Nassiri SM, Rahbarghazi R. Interactions of mesenchymal stem cells with endothelialcells. Stem Cells Dev, 2014, 23(4): 319-332.
15 Huang S, He P, Peng X, et al. Pristimerin Inhibits Prostate Cancer Bone Metastasis by Targeting PC-3 Stem Cell Characteristics and VEGF-Induced Vasculogenesis of BM-EPCs. Cell Physiol Biochem,2015, 37(1): 253-268.
16 Su CH, Wu YJ, Chang CY, et al. The increase of VEGF secretion from endothelial progenitor cells post ultrasonic VEGF gene delivery enhances the proliferation and migration of endothelial cells. Ultrasound Med Biol, 2013, 39(1): 134-145.
17 Xue J, Du G, Shi J, et al. Combined treatment with erythropoietin and granulocyte colony-s t imulat ing fac tor enhances neovascularization and improves cardiac function after myocardial infarction. Chin Med J (Engl), 2014, 127(9): 1677-1683.
18 Raida M, Heymann AC, Gunther C, et al. Role of bone morphogenetic protein 2 in the crosstalk between endothelial progenitor cells and mesenchymal stem cells. Int J Mol Med, 2006,18(4): 735-739.
19 He X, Dziak R, Yuan X, et al. BMP2 genetically engineered MSCs and EPCs promote vascularized bone regeneration in rat criticalsized calvarial bone defects. PLoS One, 2013, 8(4): e60473.
20 温丽.血管内皮祖细胞对大鼠骨髓间充质干细胞生物学特性调控作用的研究.西安:第四军医大学,2013.
21 PusztaszeriMP , SeelentagW , BosmanFT , etal . Immunohistochemical expression of endothelial markers CD31,CD34, von Willebrand factor, and Fli-1 in normal human tissues. J Histochem Cytochem, 2006, 54(4): 385-395.