医用钛合金已广泛应用于骨科内植物的生产制造,然而传统的致密钛合金内植物由于其较高的弹性模量,往往会引起应力遮挡效应,从而影响内植物与骨组织的整合并导致无菌性松动,最终影响内植物的稳定性。近年来,孔隙金属作为一种新型内植物得到了极大的关注,其具有与骨组织相似的弹性模量,而且其相互连通的孔隙结构也增大了与组织的接触面积,从而大大提高内植物的骨整合能力。制造孔隙金属的方法有很多,电子束熔融技术(Electron beam melting,EBM)作为增材制造技术(additive manufacturing ,AM)的一种,其最大的优势是可以高效地制造具有复杂结构的金属内植物,从而为个性化定制提供了可能。
将生物材料应用于组织工程最基本的要求是这种材料对组织没有不良的作用,并且具有一定的生物功能。本研究中,我们通过EBM技术制备了具有不同孔径的两种钛合金支架,并在体外对其细胞相容性及成骨性能进行了评价。我们发现孔径的差异不仅可以导致孔隙结构参数的变化,例如孔隙率、比表面积和渗透率等,而且可以对生物学性能产生一定的影响。因此在今后孔隙金属的设计和临床应用中,孔隙结构与生物性能之间的关系应该作为一个基本的考量。
1、材料与方法
1.1 孔隙金属的制备与表征
之前的研究表明大于300 μm的孔径在促进血管和组织再生上有明显的优势,因此本实验中制备了两种不同孔径的圆柱体样品,分别为具有较小孔径640μm的EBMS和较大孔径1200μm的EBML,通过EBM S12系统(Arcam AB, Sweden; 图 1a and 1b)将Ti6Al4V粉末(密度为4.3g/cm3)逐层烧结为成品。本系统主要由电子束发射装置,聚焦和偏转电子束的三个透镜以及真空室构成(图 1a)。电子束依据CAD设计数据(图 1d)在钛合金粉末上进行选择性烧结,之后在已完成的层面上重新铺粉再进行烧结,此过程反复进行最终形成产品(图 1c)。我们采用体视显微镜(SteREO Discovery, Zeiss)对样品的实际孔径进行测量,表面形貌和孔隙结构采用扫描电镜(JSM 5600 LV, JEOL, Japan)进行观察,内部连通情况及比表面积采用μCT(Inveon, Simense)测量及计算,此外渗透率的检测委托西北工业大学汪焰恩教授进行。
1.2 细胞相容性实验
使用DMEM培养液(添加10%胎牛血清及1%双抗)进行人骨髓来源间充质干细胞(hMSCs) (Lonza, Walkersville)的培养,细胞接种前,首先将支架进行消毒,然后置于24孔培养板中,每个支架接种1×105个细胞并加入1ml培养液,置于5% CO2及37 °C环境中培养,换液间隔为3天。在支架上培养3天、7天以及14天后,采用CCK-8试剂(Dojindo, Japan)对细胞活性进行检测,在第14天,采用扫描电镜对细胞形态进行观察。此外在培养3天、7天以及14天后,对培养液中细胞释放的炎症因子IL-6和IL-8使用High-sensitivity Human Cytokine Magnetic Bead Kit(Milliplex Map, Millipore)进行检测,并用细胞总蛋白含量进行校正。
1.3 成骨活性试验
为了观察材料对细胞成骨分化的影响,将一半样品培养于不具成骨诱导活性的基础培养基(basal medium, BM)中,另一半样品培养于添加了成骨诱导因子的诱导培养基(osteogenic medium, OM)中。我们检测碱性磷酸酶活性(ALP),钙含量以及成骨基因表达来反映成骨活性。在培养10天后,用0.1% Triton X-100裂解细胞使其释放碱性磷酸酶,使用Alkaline Phosphatase Assay Kit(Beyotime, China)对裂解液中ALP活性进行测定,并用细胞总蛋白含量进行校正。培养14天后,在培养板中加入1 ml 0.5 N的盐酸过夜孵育释放钙离子,并用Calcium Colorimetric Assay Kit(Sigma-Aldrich)测定钙含量。培养14天后,使用qRT-PCR检测细胞成骨相关基因ALP和骨钙素(osteocalcin , OCN)的表达量,内参基因为GAPDH,引物在表1中列出。
1.4 数据统计
采用独立样本T检验进行统计分析,结果采用均数±标准差(mean ± SD)表示,P < 0.05认为具有显著性差异,P < 0.01认为具有高度显著性差异。
2. 结果
2.1 孔隙金属表征结果
样品为高5mm直径10mm的圆柱体。从图1可以看出其具有典型的网状孔隙结构。EBMS样品的实际孔径为682μm,孔隙率为73%,单位体积比表面积为2.41 mm-1,渗透率为1.029×10-9 m2;EBML样品的实际孔径为1266μm,孔隙率为81.9%,单位体积比表面积为1.69 mm-1,渗透率为1.637×10-9 m2。可以看出两种样品的实际孔径都略大于设计孔径,偏差大约为别为6.6% 和5.5%。Micro-CT和扫描电镜的结果(图1e)表明内部结构是相互连通的,并且样品表面由于部分粉末未完全融化,呈现一种粗糙的表面形貌。
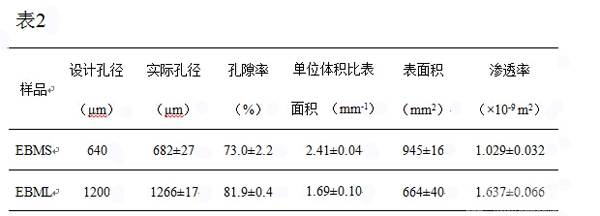
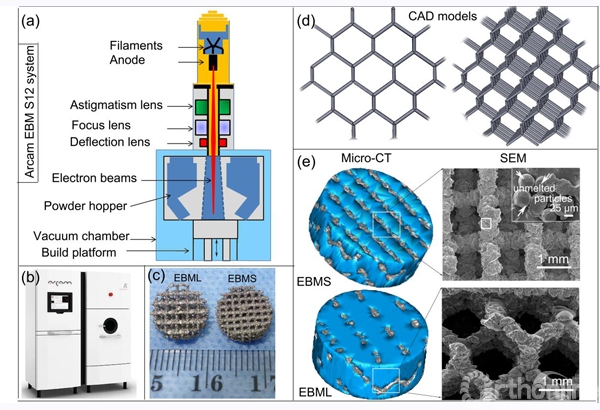
图1
2.2 细胞相容性
在第3天时,细胞活性在EBMS和EBML之间并没有表现出差异(p > 0.05,图 2a),随着培养时间的延长,细胞活性逐渐增高,在第7天和第14天,EBMS的细胞活性显著高于EBML。炎症因子的结果(图 2b)表明IL-6在两组之间没有显著性差异,在第3天和第7天时,EBML有较高浓度的IL-8。
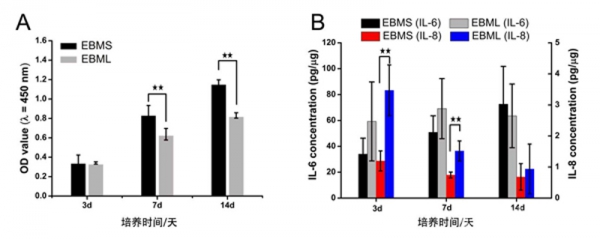
图2
2.3 成骨活性
当使用基础培养基(BM)时,虽然EBMS有较高的ALP活性以及基因表达,但两组的ALP活性、总蛋白含量、钙含量以及成骨基因的表达都保持在低水平。在加入成骨诱导因子后(OM),以上这些分化指标都显著提高,并且相比EBML,EBMS在这几个指标上都有更高的表达(图 3a)。另外通过扫描电镜观察(图 3b),细胞以一种立体桥接的方式延伸(白色箭头)并均匀分布在在材料表面,当在基础培养基中培养时,大部分细胞为扁平形态,而且没有发现钙沉积;在诱导培养基中培养时,细胞呈现分化状态,表现为骨细胞特有的丝状纤维形态,而且可以看到钙沉积(黑箭头),并且在EBMS上更加明显,这与钙定量实验结果相符。
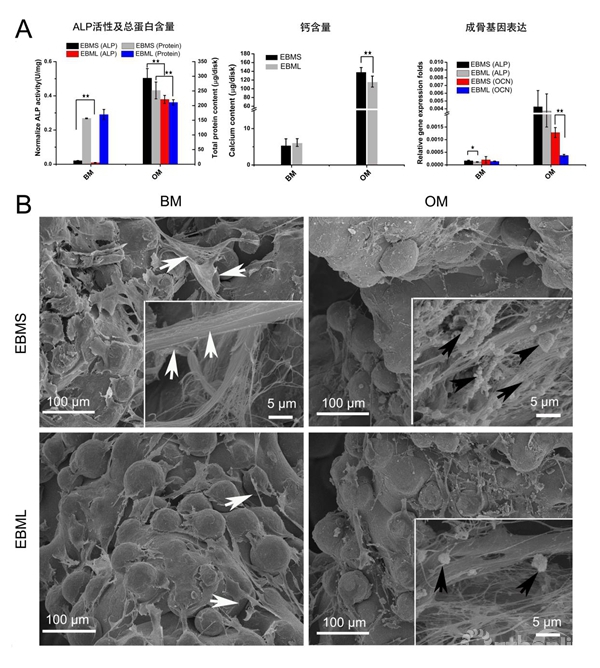
图3
3. 讨论
本实验中,我们成功的通过EBM技术制造出具有不同孔径的两种孔隙金属,整个制造过程具有良好的可控性和精确性。正如本实验所表明的,孔径是孔隙金属的一个基本设计参数,其同孔隙率、比表面积以及渗透率等指标有很高的关联性,孔径的改变可以引起这些参数的变化从而影响孔隙金属的细胞相容性以及成骨性能。
在细胞与生物材料相互作用的过程中,有两个重要因素需要考虑,首先是营养物质的输送以及代谢产物的排出,其决定于孔隙内部液体的更新速度,这与孔隙材料的渗透性关系密切;另外就是材料表面与细胞活性有关的蛋白的附着量,这与孔隙材料的表面积有关。较高的渗透性能意味着较强的物质输送能力,从而为细胞提供充足的营养进行生命活动。已有研究表明有利于促进血管与组织再生的最低渗透率为3×10-11m2,在本研究中,两组样品的渗透率为1.029×10- 9 m2 (EBMS)和 1.637×10- 9 m2 (EBML),均远高于最低限值,因此其没有对细胞的粘附与增值产生负面影响。较大的表面积可以容纳更多的与粘附相关的整合素(integrin)配体,同时也可以吸附更多的与成骨相关的因子,从而有利于细胞的增值、分化以及细胞外基质的生成。我们的结果显示,渗透率较低但比表面积较大的EBMS具有更好的细胞活性,表明比表面积的作用可能更大。由于表面积的增大,金属腐蚀碎屑的增加是孔隙金属可能带来的负面作用,有研究表明金属碎屑可使细胞产生炎症反应。本研究中,EBML在早期产生了更多的IL-8,这可能是由于其较高的渗透率引起的,但两组之间的差异并不明显。理想的生物材料应该具有支持甚至促进细胞分化及组织再生的特性。本实验中,在未添加诱导因子的情况下,与支架共培养的细胞表现出较低的分化活性,在加入成骨诱导成分后,细胞的成骨分化活性得到了明显的提升,这表明我们的钛合金孔隙金属可以支持细胞的分化,但自身并不具有诱导分化的能力,这可能是由于我们并未对材料表面进行改性以提高其生物活性。尽管如此,在诱导培养(OM)条件下,EBMS表现出较高的分化活性,这应该是由于其较大的表面积吸附了较多的成骨诱导因子。
4. 结论
本研究中,我们成功的使用EBM技术制造出两种孔径的Ti6Al4V孔隙金属。这两种材料都具有良好的细胞相容性,但由于有较大的比表面积,小孔径的材料更为优异。由于其自身并没有诱导细胞分化的特性,未来的研究方向应该集中于表面改性以进一步提高生物学性能。